Atomi: Dallime mes rishikimesh
| [redaktim i pashqyrtuar] | [redaktim i pashqyrtuar] |
v Reverted to revision 1301929 by Addbot on 2013-03-27T04:07:34Z |
No edit summary |
||
| Rreshti 29: | Rreshti 29: | ||
Ligjet themelore të kimisë, respektivisht ligjet stekiometrike të saj, argumentojnë faktin se atomet janë grimca reale dhe me të vërtetë ekzistojnë. |
Ligjet themelore të kimisë, respektivisht ligjet stekiometrike të saj, argumentojnë faktin se atomet janë grimca reale dhe me të vërtetë ekzistojnë. |
||
Zbulimet shkencore që u bënë nga ana e një numri të |
Zbulimet shkencore që u bënë nga ana e një numri të madhë shkencëtarësh (fizikan dhe kimistë) nga fundi i shek.XIX-të dhe fillimi i shek.XX-të e sidomos zbulimi i radioaktivitetit, ka treguar se ekzistojnë grimca më të vogla se atomi, gjë e cila qëndron në kundërshtim me teorinë atomike të Dalton-it. Pra, sipas Daltonit, atomi është definuar si grimcë e pandashme, dhe kjo është përmendur që moti në Greqinë e vjetër nga Demokriti, i cili për atomin thotë ,,a-tomos’’,(nga greqishtja, a-jo, dhe tomos-i ndarë). |
||
Supozimi se atomi është i pandashëm ka qenë i pranuar si një e vërtetë absolute, për ç’arsye edhe është dashur që të gjitha vrojtimet të cilat kanë treguar se atomi është pjesë e përbërë, të hulumtohen në mënyrë sistematike që të fitohen të dhëna të sigurta eksperimentale, si vërtetim i sigurt në kompleksitetin e strukturës së atomit. Ndër zbulimet më të rëndësishme, që drejtpërdrejtë kontribuon në njohjen e strukturës së brendshme të atomit, janë: |
Supozimi se atomi është i pandashëm ka qenë i pranuar si një e vërtetë absolute, për ç’arsye edhe është dashur që të gjitha vrojtimet të cilat kanë treguar se atomi është pjesë e përbërë, të hulumtohen në mënyrë sistematike që të fitohen të dhëna të sigurta eksperimentale, si vërtetim i sigurt në kompleksitetin e strukturës së atomit. Ndër zbulimet më të rëndësishme, që drejtpërdrejtë kontribuon në njohjen e strukturës së brendshme të atomit, janë: |
||
zbulimi i dukurisë së “radioaktivitetit”, |
zbulimi i dukurisë së “radioaktivitetit”, |
||
| Rreshti 41: | Rreshti 41: | ||
Bërthama e Atomit |
Bërthama e Atomit |
||
Bërthama – Është një grimcë komplekse dhe në të gjenden dy grimca sublimentare: protoni – si grimcë me ngarkesë elektrike pozitive dhe neutroni – si grimcë elektroneutrale. Bërthama është përafërsisht |
Bërthama – Është një grimcë komplekse dhe në të gjenden dy grimca sublimentare: protoni – si grimcë me ngarkesë elektrike pozitive dhe neutroni – si grimcë elektroneutrale. Bërthama është përafërsisht për 10.000 herë më e vogël se vetë atomi. Diametri i atomit është përafërsisht 10-10m (disa të dhjeta pjesë të nanometrit), ndërsa diametri i bërthamës është përafërsisht 10-14m, ose 10-3nm. Pra, pjesa më e madhe e hapësirës së atomit është “e zbrazur”. |
||
Për të ilustruar këtë lidhshmëri ndërmjet dimensioneve të bërthamës dhe atomit, supozojmë se, për shembull, nëse atomin e zmadhojmë për 100 miliardë herë, atëherë do të fitonim-një top me diametër prej afër 10m, në qendrën e të cilit do të gjendej bërthama me madhësi sa koka e gjilpërës (me diametër prej afër 1mm). |
Për të ilustruar këtë lidhshmëri ndërmjet dimensioneve të bërthamës dhe atomit, supozojmë se, për shembull, nëse atomin e zmadhojmë për 100 miliardë herë, atëherë do të fitonim-një top me diametër prej afër 10m, në qendrën e të cilit do të gjendej bërthama me madhësi sa koka e gjilpërës (me diametër prej afër 1mm). |
||
Protoni – (greq. protos – i pari) – është grimcë elektropozitive, ngarkesa elektrike pozitive e të cilit është 1,6020 × 1519c (kulona), ndërsa masa e protonit praktikisht është aq sa edhe masa e atomit të hidrogjenit. Protonin e ka zbuluar Ratherfordi në vitin 1919. protonin shkurtimisht e shënojmë me shenjën p. Numrin e përgjithshëm të protoneve në bërthamën e një atomi e shënojmë me z. Ky numër njëherit paraqet edhe numrin rendor të elementit në sistemin periodik të elementeve. |
Protoni – (greq. protos – i pari) – është grimcë elektropozitive, ngarkesa elektrike pozitive e të cilit është 1,6020 × 1519c (kulona), ndërsa masa e protonit praktikisht është aq sa edhe masa e atomit të hidrogjenit. Protonin e ka zbuluar Ratherfordi në vitin 1919. protonin shkurtimisht e shënojmë me shenjën p. Numrin e përgjithshëm të protoneve në bërthamën e një atomi e shënojmë me z. Ky numër njëherit paraqet edhe numrin rendor të elementit në sistemin periodik të elementeve. |
||
Versioni i datës 4 qershor 2013 23:03
--79.106.109.208 5 dhjetor 2012 20:49 (CET)--79.106.109.208 5 dhjetor 2012 20:49 (CET)''Tekst i theksuar
- Rresht me kryeradhë
- Numbered list item
- Bulleted list item
Tekst të vogëlTekst të madheTekst të madheTekst të madheTekst të madheTekst të madheTekst të madheTekst të madheTekst të madhe
-
P
ërshkrim1 ((Ns: file)): Shembull.jpg | Përshkrim2 </gallery>
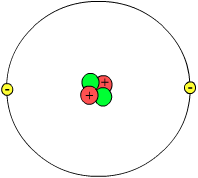
Për herë të parë ky term është përdorur nga filozofi i Greqisë së lashtë Demokriti (460 p.e.s.-370 p.e.s.) i cili me këtë fjalë emërtonte atë element të materies që nuk ndahet më d.m.th atomi greqisht atomo (ατομο) = fjalë e përbërë nga parafjala a=pa + tomo, temno=presë, ndaj, ajo që nuk pritet më. Më pas Xhon Daltoni i vërtetoi botëkuptimet e filozofëve Demokriti dhe Leukipi. Ai përfundoi se materia eshë e ndërtuar prej grimcave te vogla te cilat nuk mund te ndahen prej ti me metoda kimike. Këto grimca janë atomet.
Atomi është i përbëre nga bërthama dhe elektronet me ngarkesë elektrike negative që rrotullohen rreth saj, në brendësin e bërthamës gjejmë neutronet që janë thërrmija pa ngarkesë elektrike dhe protonet me ngarkesë elektrike pozitive. Për çdo atom në gjendje normale numri i protoneve është i barabartë me numrin e elektroneve. Kur numri protoneve është i barabarte me numrin e elektroneve themi atëherë që atomi është neutral.
Ndërsa kur atomi humb një ose më shumë elektrone ngarkesa e tij nuk është me neutrale (zero), sepse duke humbur ngarkesat negative të elektroneve, atij i kanë mbetur vetëm ngarkesat pozitive te protoneve ne bërthame, atëherë themi se atomi është shndërruar në një jon pozitiv ose kation. Ndërsa, kur atomit i bashkohen një ose më shumë elektrone, ky nuk është me neutral, sepse i janë shtuar elektrone me ngarkesa negative, pra edhe një herë kemi të bëjmë me shndërrimin e një atomi në një jon por kësaj radhe jon negativ ose anion.
Që atomi është i pandashëm mund te thuhej kur ne nuk e njihnim akoma natyrën e një atomi, tani mund te konfirmojmë që atomet janë te ndashëm sepse edhe humbja e një elektroni do te thotë ndarje e tij. Për me tepër shkenca ka ecur shumë përpara saqë tani është e mundur edhe ndarja e bërthamës së një atomi, ky veprim quhet fision nuklear dhe është i mundur në centralet nukleare. Atomet e elementve te nryshem bashkveprojne ndermjet tyre dhe gjate ketij bashkveprimi njeri nga elementet ka aftesi te jap elektrone ndersa elementi tjeter është i prirur te marre elektrone ne shtresen e jashtme.
| Ky artikull është i cunguar. Ju mund të ndihmoni Wikipedian duke e zgjeruar atë. |
Nils Bor (Niels Bohr): Është gabim të thuhet se fizika shërben për të gjetur se si funksionon natyra. Fizika merret me atë çfarë mund të themi ne për natyrën!..
ATOMI_HYRJE
Ligjet themelore të kimisë, respektivisht ligjet stekiometrike të saj, argumentojnë faktin se atomet janë grimca reale dhe me të vërtetë ekzistojnë. Zbulimet shkencore që u bënë nga ana e një numri të madhë shkencëtarësh (fizikan dhe kimistë) nga fundi i shek.XIX-të dhe fillimi i shek.XX-të e sidomos zbulimi i radioaktivitetit, ka treguar se ekzistojnë grimca më të vogla se atomi, gjë e cila qëndron në kundërshtim me teorinë atomike të Dalton-it. Pra, sipas Daltonit, atomi është definuar si grimcë e pandashme, dhe kjo është përmendur që moti në Greqinë e vjetër nga Demokriti, i cili për atomin thotë ,,a-tomos’’,(nga greqishtja, a-jo, dhe tomos-i ndarë). Supozimi se atomi është i pandashëm ka qenë i pranuar si një e vërtetë absolute, për ç’arsye edhe është dashur që të gjitha vrojtimet të cilat kanë treguar se atomi është pjesë e përbërë, të hulumtohen në mënyrë sistematike që të fitohen të dhëna të sigurta eksperimentale, si vërtetim i sigurt në kompleksitetin e strukturës së atomit. Ndër zbulimet më të rëndësishme, që drejtpërdrejtë kontribuon në njohjen e strukturës së brendshme të atomit, janë: zbulimi i dukurisë së “radioaktivitetit”, zbulimi i “rrezeve katodike”, fenomeni fotoelektrik, difraksioni i rrezeve të rëntgenit, analiza spektrale etj. Në bazë të rezultateve të fituara gjatë studimit të dukurive të përmendura u vërtetua se atomet janë grimca të përbëra (komplekse), elektroneutrale, respektivisht në përbërjen e tyre gjenden tri lloj grimcash përbërse: protonet, neutronet dhe elektronet.
Bërthama e Atomit
Bërthama – Është një grimcë komplekse dhe në të gjenden dy grimca sublimentare: protoni – si grimcë me ngarkesë elektrike pozitive dhe neutroni – si grimcë elektroneutrale. Bërthama është përafërsisht për 10.000 herë më e vogël se vetë atomi. Diametri i atomit është përafërsisht 10-10m (disa të dhjeta pjesë të nanometrit), ndërsa diametri i bërthamës është përafërsisht 10-14m, ose 10-3nm. Pra, pjesa më e madhe e hapësirës së atomit është “e zbrazur”. Për të ilustruar këtë lidhshmëri ndërmjet dimensioneve të bërthamës dhe atomit, supozojmë se, për shembull, nëse atomin e zmadhojmë për 100 miliardë herë, atëherë do të fitonim-një top me diametër prej afër 10m, në qendrën e të cilit do të gjendej bërthama me madhësi sa koka e gjilpërës (me diametër prej afër 1mm). Protoni – (greq. protos – i pari) – është grimcë elektropozitive, ngarkesa elektrike pozitive e të cilit është 1,6020 × 1519c (kulona), ndërsa masa e protonit praktikisht është aq sa edhe masa e atomit të hidrogjenit. Protonin e ka zbuluar Ratherfordi në vitin 1919. protonin shkurtimisht e shënojmë me shenjën p. Numrin e përgjithshëm të protoneve në bërthamën e një atomi e shënojmë me z. Ky numër njëherit paraqet edhe numrin rendor të elementit në sistemin periodik të elementeve. Neutroni – është grimcë elektroneutrale, dhe sipas kësaj vetie e ka marrë emrin. Masa e tij praktikisht, është e barabartë me masën e protonit. Neutronin e ka zbuluar shkencëtari anglez Çedviku (J.Chadwick) në vitin 1932. këtë grimcë e shënojmë me shenjën n. Numrin e përgjithshëm të neutroneve në bërthamë e shënojmë me N. Shuma e numrit të protoneve dhe të neutroneve në bërthamë (nukleus) quhet numri i masës dhe shënohet me Am (Am = Z+N). Protonet dhe neutronet shpeshherë quhen me një emër të përbashkët edhe neuklone. Pos protoneve dhe neutroneve janë gjetur edhe shumë grimca të tjera të përkohshme, të cilat nuk kanë ndonjë rëndësi të posaçme në strukturën e atomit. Mbështjellësi elektronik – Është pjesa më e madhe e atomit në të cilin janë të vendosura elektronet. Ajo është e përbërë prej shtresave elektronike që sot janë të njohura shtatë shtresa, të cilat i shënojmë me shkronja të alfabetit, ato janë: K,L,M,N,O,P,Q. Në këto shtresa janë të vendosura elektronet, numri i përgjithshëm (i mundshëm) i vendosjes së elektroneve është 280 c-, të cilat gjenden në lëvizje të përhershme rreth bërthamës dhe njëkohësisht rreth boshtit të vet. Elektroni – Është grimcë e elektrizuar negativisht, ngarkesa elektrike e të cilit është e barabartë me ngarkesën elektrike të protonit, por me shenjë të kundërt (1,6020 × 10-19C) . Numri i elektroneve në atom është i barabartë me numrin e protoneve. Prandaj, atomi si tërësi është thërmi elektroneutrale. Masa e elektronit është afër 1836 herë më e vogël se masa e protonit, respektivisht se masa e atomit të hidrogjenit. Masa absolute e elektronit është 9,109 × 10-21kg, ose 5,4 × 10-4 d. Diametri i elektronit është përafërsisht 5,64 ×10-15m. Shenja për elektronin është e. Elektronin e zbuloi fizikani anglez Xh. Tomsoni (J. Thomson), në vitin 1897. Ai e zbuloi elektronin, duke i studiuar vetitë e rrezeve katodike nën veprimin e rrezeve magnetike dhe elektrike.
Izotopet – Kanë veti të njëjta kimike (sepse ato varen prej konfiguracionit elektronik), ndërsa masa të ndryshme, për shkak të numrave të ndryshëm të neutroneve që e përbëjnë nukleusin e tyre. Shënimi i izotopeve bëhet ashtu që pranë simbolit, majtas poshtë shënohet numri rendor, kurse majtas lart shënohet numri i masës, p.sh. -paraqet (hidrogjenin e rëndomtë ose protoniumin); - shënohet me D (deutoriumi) dhe -shënohet me T (triciumi), apo shembulli në figurën poshtë, tregon izotopet e atomit të karbonit::6C12, 6C13, dhe 6C 14. Zbulimi i izotopeve ka mundësuar të sqarohet se për ç’arsye masat atomike relative të elementeve nuk janë numra të plotë. Pasi që elementet në natyrë paraqiten si përzierje e izotopeve të tyre, masa relative atomike e ndonjë elementi paraqet vlerën mesatare të masave atomike relative të të gjitha izotopeve përkatëse që gjenden në natyrë.
Nils Bor (Niels Bohr): Është gabim të thuhet se fizika shërben për të gjetur se si funksionon natyra. Fizika merret me atë çfarë mund të themi ne për natyrën!..
ATOMI_HYRJE
Ligjet themelore të kimisë, respektivisht ligjet stekiometrike të saj, argumentojnë faktin se atomet janë grimca reale dhe me të vërtetë ekzistojnë. Zbulimet shkencore që u bënë nga ana e një numri të madh shkencëtarësh (fizikan dhe kimistë) nga fundi i shek.XIX-të dhe fillimi i shek.XX-të e sidomos zbulimi i radioaktivitetit, ka treguar se ekzistojnë grimca më të vogla se atomi, gjë e cila qëndron në kundërshtim me teorinë atomike të Dalton-it. Pra, sipas Daltonit, atomi është definuar si grimcë e pandashme, dhe kjo është përmendur që moti në Greqinë e vjetër nga Demokriti, i cili për atomin thotë ,,a-tomos’’,(nga greqishtja, a-jo, dhe tomos-i ndarë). Supozimi se atomi është i pandashëm ka qenë i pranuar si një e vërtetë absolute, për ç’arsye edhe është dashur që të gjitha vrojtimet të cilat kanë treguar se atomi është pjesë e përbërë, të hulumtohen në mënyrë sistematike që të fitohen të dhëna të sigurta eksperimentale, si vërtetim i sigurt në kompleksitetin e strukturës së atomit. Ndër zbulimet më të rëndësishme, që drejtpërdrejtë kontribuon në njohjen e strukturës së brendshme të atomit, janë: zbulimi i dukurisë së “radioaktivitetit”, zbulimi i “rrezeve katodike”, fenomeni fotoelektrik, difraksioni i rrezeve të rëntgenit, analiza spektrale etj. Në bazë të rezultateve të fituara gjatë studimit të dukurive të përmendura u vërtetua se atomet janë grimca të përbëra (komplekse), elektroneutrale, respektivisht në përbërjen e tyre gjenden tri lloj grimcash përbërse: protonet, neutronet dhe elektronet.
Bërthama e Atomit
Bërthama – Është një grimcë komplekse dhe në të gjenden dy grimca sublimentare: protoni – si grimcë me ngarkesë elektrike pozitive dhe neutroni – si grimcë elektroneutrale. Bërthama është përafërsisht nja 10.000 herë më e vogël se vetë atomi. Diametri i atomit është përafërsisht 10-10m (disa të dhjeta pjesë të nanometrit), ndërsa diametri i bërthamës është përafërsisht 10-14m, ose 10-3nm. Pra, pjesa më e madhe e hapësirës së atomit është “e zbrazur”. Për të ilustruar këtë lidhshmëri ndërmjet dimensioneve të bërthamës dhe atomit, supozojmë se, për shembull, nëse atomin e zmadhojmë për 100 miliardë herë, atëherë do të fitonim-një top me diametër prej afër 10m, në qendrën e të cilit do të gjendej bërthama me madhësi sa koka e gjilpërës (me diametër prej afër 1mm). Protoni – (greq. protos – i pari) – është grimcë elektropozitive, ngarkesa elektrike pozitive e të cilit është 1,6020 × 1519c (kulona), ndërsa masa e protonit praktikisht është aq sa edhe masa e atomit të hidrogjenit. Protonin e ka zbuluar Ratherfordi në vitin 1919. protonin shkurtimisht e shënojmë me shenjën p. Numrin e përgjithshëm të protoneve në bërthamën e një atomi e shënojmë me z. Ky numër njëherit paraqet edhe numrin rendor të elementit në sistemin periodik të elementeve. Neutroni – është grimcë elektroneutrale, dhe sipas kësaj vetie e ka marrë emrin. Masa e tij praktikisht, është e barabartë me masën e protonit. Neutronin e ka zbuluar shkencëtari anglez Çedviku (J.Chadwick) në vitin 1932. këtë grimcë e shënojmë me shenjën n. Numrin e përgjithshëm të neutroneve në bërthamë e shënojmë me N. Shuma e numrit të protoneve dhe të neutroneve në bërthamë (nukleus) quhet numri i masës dhe shënohet me Am (Am = Z+N). Protonet dhe neutronet shpeshherë quhen me një emër të përbashkët edhe neuklone. Pos protoneve dhe neutroneve janë gjetur edhe shumë grimca të tjera të përkohshme, të cilat nuk kanë ndonjë rëndësi të posaçme në strukturën e atomit. Mbështjellësi elektronik – Është pjesa më e madhe e atomit në të cilin janë të vendosura elektronet. Ajo është e përbërë prej shtresave elektronike që sot janë të njohura shtatë shtresa, të cilat i shënojmë me shkronja të alfabetit, ato janë: K,L,M,N,O,P,Q. Në këto shtresa janë të vendosura elektronet, numri i përgjithshëm (i mundshëm) i vendosjes së elektroneve është 280 c-, të cilat gjenden në lëvizje të përhershme rreth bërthamës dhe njëkohësisht rreth boshtit të vet. Elektroni – Është grimcë e elektrizuar negativisht, ngarkesa elektrike e të cilit është e barabartë me ngarkesën elektrike të protonit, por me shenjë të kundërt (1,6020 × 10-19C) . Numri i elektroneve në atom është i barabartë me numrin e protoneve. Prandaj, atomi si tërësi është thërmi elektroneutrale. Masa e elektronit është afër 1836 herë më e vogël se masa e protonit, respektivisht se masa e atomit të hidrogjenit. Masa absolute e elektronit është 9,109 × 10-21kg, ose 5,4 × 10-4 d. Diametri i elektronit është përafërsisht 5,64 ×10-15m. Shenja për elektronin është e. Elektronin e zbuloi fizikani anglez Xh. Tomsoni (J. Thomson), në vitin 1897. Ai e zbuloi elektronin, duke i studiuar vetitë e rrezeve katodike nën veprimin e rrezeve magnetike dhe elektrike.
Izotopet – Kanë veti të njëjta kimike (sepse ato varen prej konfiguracionit elektronik), ndërsa masa të ndryshme, për shkak të numrave të ndryshëm të neutroneve që e përbëjnë nukleusin e tyre. Shënimi i izotopeve bëhet ashtu që pranë simbolit, majtas poshtë shënohet numri rendor, kurse majtas lart shënohet numri i masës, p.sh. -paraqet (hidrogjenin e rëndomtë ose protoniumin); - shënohet me D (deutoriumi) dhe -shënohet me T (triciumi), apo shembulli në figurën poshtë, tregon izotopet e atomit të karbonit::6C12, 6C13, dhe 6C 14. Zbulimi i izotopeve ka mundësuar të sqarohet se për ç’arsye masat atomike relative të elementeve nuk janë numra të plotë. Pasi që elementet në natyrë paraqiten si përzierje e izotopeve të tyre, masa relative atomike e ndonjë elementi paraqet vlerën mesatare të masave atomike relative të të gjitha izotopeve përkatëse që gjenden në natyrë.atomi eshte therrmija me e vogel qe ekziston ..(kari) KY NILS BORI KA QENE NJE MOTER QIRE QE DUHET ME JA QI MOTREN NE PIDH SE ESHTE SHUME RRT KARI ASIGJO NUK KA SHPIK VETEM SA KA MARRE LEK KOT QYL ROPSHI .......
Shiko dhe këtë
Lidhje të jashtme
http://filolet.com/demokriti.htm
- Reaksionet dhe Energjia Bërthamore - Gjimnazi Sami Frashëri - dokument në internet, prill 2007
