Tipet e lidhjeve kimike në kristale
Tipet e lidhjeve kimike në kristale paraqesin format dhe llojet e lidhjeve të atomeve në molekulat e kristaleve (trupave të ngurtë).
Varësisht nga natyra e lidhjes, në kristale kemi keto lloje të lidhjeve kimike:
Lidhja e Van der Waalsit[1]
[Redakto | Redakto nëpërmjet kodit]Në mes të atomeve me shtresa elektronike të mbyllura (gazet fisnike-inerte) ose mes molekulave mund të paraqiten forca bashkëvepruese të njohura si forca të Van der Waalsit. Burim I këtyre forcave është bashkëveprimi mes poleve elektrike, të cilat për nga intensiteti janë shumë të vogla. Forcat e tilla janë shkaktare që gazrat në temperature mjaft të ulëta të kondensojnë në fluide, kurse për temperature akoma më të ulëta në kristale. Por vlenë edhe e kundërta, duke sjell pak energji, d.m.th. duke ngritur temperaturën, lidhjet e tipit të Van der Waalsit prishen. Këto kristale karakterizohen me atome me energji të lartë të jonizimit, si dhe kanë energji të vogël kohezioni. Si të tilla, këto atome mund të paketohen shumë afër njëri tjetrit (rast tipik është struktura kristaline e atomeve të gazrave inerte- përjashtim bëjnë izotopi i tretë(He3) dhe I katërt(He4) I heliumit).

Në parim format e bashkëveprimit të tipit të Van der Waalsit në molekulë janë:
- Forca e bashkëveprimit dipol-dipol mes molekulave me moment dipolar permanent,p.sh. të ashtuquajturat molekulat polare të ujit H2O,
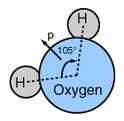
- Forca e bashkëveprimit dipol-dipol, e induktuar mes një molekule me moment dipolar permanent dhe një molekulë tjetër me moment dipolar të induktuar.
- Forca e bashkëveprimit mes dy molekulave ose atomeve jo polare, te të cilat vlera mesatare e momentit dipolar është zero, mirpo si rezultat I një fluktuacioni të densitetit të ngarkesave shumë shkurtë lindin momente dipolare të cilat shkaktojnë tërheqjen e molekulave ose atomeve.
Sipas mekanikës kuantike, gjatë afrimit të atomeve vjen deri tek mbulimi I pjesshëm I reve elektronike të atomeve me ç’rast do të kemi edhe një ndryshim të energjisë së plotë të sistemit. Për një mbulim të plotë në bazë të parimit të Paulit, energjia përkatësisht forca e bashkëveprimit do të jetë refuzuese, kjo ndodhë pasi që ekziston tendenca që elektronet e njërit atom të zënë pjesërisht edhe gjendjen e atomit të dytë, gjë që sipas parimit të Paulit nuk mund të ndodhë, kurse në aspektin energjetik, energjia e plotë e sistemit do të rritet. [1]
Lidhja jonike[2]
[Redakto | Redakto nëpërmjet kodit]Joni paraqet atomin i cili ka mungesë ose tepër një e më shumë elektrone. Atomi me një e më shumë elektrone quhet joni negative ose anioni kurse atomi me më pak se një e me tepër elektrone quhet joni pozitiv ose kationi. Kur këto jone gjenden në distanca të krahasueshme me përmasat e atomeve, atëherë mes tyre paraqitet forca tërheqëse e tipit Kulonian. Kjo forcë e mban stabil këtë qift anion-kation, pra qiftin e mban të lidhur, prandaj edhe lidhja si e tillë quhet lidhje jonike. Për të kuptuar më lehtë, do të marrim rastin e litium fluorit LiF e cila përbëhet nga dy atome të cilat kanë karakteristika shumë të ndryshme ndërmjet veti. Li është element i cili gjendet në kolonën e parë, pra është element alkalik, kurse F është element kimik i cili gjendet në kolonën e shtatë. Që të dy kanë tendencë të kenë strukturë elektronike sikurse atomet e gazeve inerte, për këtë arsye, nëse këto dy atome ndodhen në distancë të caktuar (të krahasueshme me dimensionet e atomeve), atëherë struktura elektronike e tyre do të ndryshojë. Konfiguracioni elektronik i tyre është, Li: 1s2 2s1 ; F:1s2 2s2 2p5, kurse energjia e jonizimit për F është shumë më e madhe se sa për atomin e Li, kjo do të thotë se për shkakt të tendencës që sistemi të ketë minimum energjie, një electron nga Li natyrshëm kalon tek ai i F dhe kështu të dy atomet fitojnë struktura elektronike të ngjashme me ato të gazrave inerte (F do të ketë strukturë elektronike sikurse të Ne, kurse Li sikurse te He). Elektroni i cili kalon nga njëri atom tëk tjetri do të jetë burim ose “arsyeja” që të krijohet lidhja në mes të atomeve. Tani struktura elektronike e atomeve përkatsisht joneve do të jetë: Li+:1s2 ; F-:1s2 2s2 2p5 . Pasi që të kaloi elektroni i Li në atë të F , shpërndarjet e elektroneve nëpër orbita do të jenë të njëjta sikurse ato të atomeve të gazrave inerte- shpërndarje me simetri sferike. NaCl është përfaqësues tipik i lidhjes jonike.

Lidhja kovalente[3]
[Redakto | Redakto nëpërmjet kodit]Lidhjet te molekulat e H2, O2, N2, si dhe te strukturat kristaline të tipit të diamantit nuk mund të sqarohen as për mes teorisë mbi lidhjen e Van der Ëaalsit e as me atë të lidhjes jonike. Me fjalë të tjera, nuk mund të gjykohet se atome të njëjta- pra ato të cilat kanë energji të jonizimit të njëjtë të ndërtojnë lidhje të tipit jonik, që do të thotë se njëri prej atomeve do të shndërrohet në jon negative e tjetri në atë pozitiv!. Nga ana tjetër, intensiteti i këtyre forcave lidhëse është shumë më i madhë se ai i forcave të Van der Ëaalsit.Ky tip i lidhjes njihet si lidhje homopolare ose lidhje kovalente- d.m.th. lidhje e cila krijohet mes atomeve me valencë, polaritet të njëjtë.
Natyrën e kësaj force po e sqarojmë përmes lidhjes në molekulën e hidrogjenit. Supozojmë se dy atome të H, A dhe B gjendën në disatancë shumë të madhe njëri nga tjetri. Pasi qe densitetet e reve elektronike të cilat paraqesin gjendjet elektronike në atome shumë shpejtë bien me rritjen e distancës nga bërthamat, atëherë po thuaj se fare nuk do të ketë besueshmëri të kalimit të elektronit të atomit A në fushën e bërthamës së atomit B dhe anasjelltas. Andaj atomet A dhe B mund të trajtohen si të izoluara, kurse energjia e tyre të llogaritet si shumë e energjive të dy atomeve 2E0, ku E0 është energjia e atomit H. Duke u afruar do të rritet edhe bësueshmëria e kalimit të elektronit nga njëri atom në tjetrin. Kështu që, për R≈2Å do të kemi mbulim të reve elektronike në hapsirën mes dy atomeve, kurse bësueshmëria e kalimit do të jetë shumë e madhe, diku rreth 1014 kalime në sekondë. Nëse akoma zvoglohet distanca mes atomeve, shkalla e mbulimit të reve elektronike do të rritet dhe njëkohësisht do të rritet edhe besueshmëria e kalimit të elektronit nga atome amë tek ai i “huaji” osë fqinjë. Pra në fakt për distancë të caktuar, shkalla e mbulimit dhe besueshmëria e kalimit do të jenë aq të mëdha sa që më nuk do të ketë kuptim të flitet për përkatësin “amtare” të elektroneve por do kemi të ashtuquajturin fenomen të kolektivizmit.

Gjatë këtij fenomeni do vije deri tek rishpërndarja e densitetit të elektroneve si dhe ndryshimi i energjisë në krahasim me energjinë 2E0. Densiteti i shpërndarjeve elektronike në rastin e atomeve të izoluara është simetrik ndaj bërthamës. Çdo herë mes atomeve do kemi rritje të densitetit të shpërndarjes së elektroneve gjë që ka si pasoj edhe rritjen e besueshmërisë së kalimit të elektroneve prej njërit atom tek tjetri. Rritja e dendësitetit të shpërndarjes së elektroneve në zonën në mes të bërthamave të atomeve, ka si pasoj zvogëlimin e energjisë së sistemit në krahasim me shumën e energjive të atomeve të izoluara dhe si rezultat do të kemi paraqitjen e forcës tërheqëse mes atomeve. Shprehur figurativisht, reja elektronike mes atomeve e cila krijohet si rezultat i kolektivizimit të dy elektroneve tenton që të i afroj bërthamat e atomeve sa më afër që është e mundur. Pra, ky është përshkrimi kualitativ i lidhjes kovalente, tek e cila në parim gjatë procesit të kolektivizimit ndodhë efekti i shkëmbimit të elektroneve mes atomeve (thjeshtë nuk ka kuptim më të flitet për atë se cili electron i takon cilit atom). Efekti i shkëmbimit është efekt i pastër kuantik dhe si i tillë mund të sqarohet vetëm në bazë të ligjeve kuantike. Karakteristikat e lidhjes kovalente janë: vetia e ngopjes si dhe vetia e orientimit. Vetia e ngopjes nënkupton se secili atom mund të formoj lidhje kovalente vetëm me numër të caktuar të fqinjëve të vetë- ose edhe më saktë vetëm nga dy elektrone me spine antiparalele marrin pjesë në krijimin e lidhjes kovalente. Nëse lidhjes kovalente i shtohet edhe një elektron, atëherë do të kemi një gjendje me spine paralele ose antisimetrike dhe si rezultat paraqitet forca dëbuese e cila qon në destabilizimin e lidhjes. Varësisht nga numri i elektroneve valente që ka atomi, aim und të krijoj një ose më tepër lidhje kovalente. P.sh. Atomi i hidrogjenit ka vetëm një elektron valent, kjo nënkupton se ai vetëm me një atom tjetër të hidrogjenit mund të krijoj lidhje kovalente- molekula e përbër nga dy atome të hidrogjenit, kurse atomi i germaniumit që ka katër elektrone valente mund të krijoj katër lidhje kovalente me katër atome tjera të germaniumit. Sa i përket vetis së orientimit, në bazë të mekanikës valore dhe hulumtimeve eksperimentale është vërtetuar se, lidhjet kovalente formohen në drejtim te të cilave shtrihet pjesa dominuese e resë elektronike të elektroneve valente të atomeve me ç’rast do të kemi edhe stabilitet të lidhjes. Pikërisht duke u bazuar në këtë fakt, mund të sqarohet se pse C, Si, Ge kanë strukturë diamanti, edhe pse struktura e tillë ka hapsirë boshe mjaftë të madhe- diku 34% të hapsirës është e “mbushur” me atome kurse tjetra është boshe. Parimisht ekzistojnë kristalet tek të cilat me siguri të plotë mund të thuhet se është e pranishme lidhja kovalente ose ajo jonike. Por ekzistojnë edhe raste tek të cilat duhet vlerësuar me kujdes se deri në ç’masë një lidhje është kovalente ose jonike. Në përgjithësi mund të thuhet se, atomet te të cilat pothuajse kanë të mbushur shtresen e fundit me elektrone, ato kanë tendencë të krijimit të lidhjeve jonike, ndërsa atomet e grupit të II, III dhe IV kanë tendencë të krijimit të lidhjeve kovalente.
Lidhja metalike
[Redakto | Redakto nëpërmjet kodit]Një grup i veçantë i trupave të ngurtë janë metalet të cilat në sistemin periodic të elementeve zakonisht gjenden në fillim të periodave, p.sh. Li, Be, Na, Mg, Al, etj. Ky grup i turpave të ngurtë ka veti të dallueshme fizike nga të tjerët, veti të cilat burojnë nga natyra e lidhjes mes atomeve të metaleve. Ky tip i lidhjes nuk mund të sqarohet as nga pikepamja e lidhjes jonike e as nga ajo kovalente. Në fakt, lidhja jonike formohej nga atomet të cilat për nga numri i elektroneve në shtresën e fundit dalloheshin shumë, pra kishin energji të jonizimit të ndryshme, p.sh. lidhja ndërmjet një atomi metalik dhe një atomi halogjen. Është normale se një lidhje e këtij lloji nuk mund të krijohet mes atomeve që kanë strukturë të njëjtë elektronike, përkatësisht energji të njëjtë jonizimi. Nga ana tjetër, atomet e elementeve metalike nuk kanë numer të mjaftueshëm elektronesh në shtresën e fundit për të krijuar lidhje të tipit kovalent me atomet fqinjë. P.sh. atomi i bakrit ka këtë strukturë elektronike 1s2 2s2 2p6 3s2 3p6 3d10 4s1, d.m.th. ka një elektron valent për mes së cilit do të krionte lidhje kovalente me një atom tjetër të bakrit. Mirëpo rezultatet eksperimentale vërtetojnë te rrjeta kristaline të bakrit, çdo atom i bakrit është i shoqëruar me dymbëdhjet atome tjera të bakrit. Kjo jep për të kuptuar se absolutisht nuk bëhet fjalë për lidhje të tipit kovalent. Me fjalë të tjera tek metalet kemi të bëjmë me një lidhje të vacant të njohur si lidhje metalike.
Për të krijuar më lehtë idenë e lidhjeve metalike do t’i referohemi një rezultati eksperimental te rrjeta e magnezit. Përmes difraksionit të rreze rëntgen, te kjo rrjetë është gjetur se densiteti i elektroneve mes nyjeve të rrjetës është konstant, kurse vetëm rreth nyjeve- pozitave ku janë atomet e Mg kemi një kërcim i cili është rezultat i pranisë së elektroneve të shtresave të brendshme. Me fjalë të tjera, përgjatë tërë vëllimit të kristalit të Mg do të kemi densitet konstant të elektroneve vetëm se rreth nyjeve kemi ngritje të këtij densiteti. Kjo e dhënë eksperimentale na jep për të kuptuar se, me siguri vetëm elektroni valent po lirohet nga atomi dhe kështu ai po shndërrohet në jon negativ në të kundërtën nuk mund të kuptohet kjo diferenc kaq e madhe në densitet të elektroneve. Dihet se elektronet valente të atomeve metalike janë dobët të lidhur për atomi, kështu që gjatë formimit të trupit të ngurtë, atomet pozicionohen afër njëri tjetrit (distanca e rendit Angstrem) dhe me këtë rast elektronet valente do të jenë në gjendje të lirojnë atomet amë dhe të lëvzin lirisht brenda për brenda kristalit. Kjo liri e lëvizjes është rrjedhojë kryesore e përcjellshmërisë elektrike shumë të mirë të rrymës elektrike nga ana e metaleve. Prandaj mund të gjykojmë se lidhja metalike është lidhje e cila krijohet mes joneve të atomeve metalike dhe elektroneve të lira. Jo rrallë këto elektrone të lira quhen edhe si gaz elektronik, kurse teoria e përshkrimit mund të krahasohet me teorinë kinetike molekulare të gazrave. Në fakt, elektronet e lira “notojnë” për gjatë vëllimit të kristalit duke baraspeshuar forcat dëbuese të cilat paraqiten mes joneve negative të rrjetës. Pra, ngjashëm sikurse tek lidhja kovalente edhe këtu po ndodhë procesi i kolektivizimit, mirpo për dallim prej lidhjes kovalente ku në kolektivizim marrin pjesë vetëm dy elektrone me spine antiparalele, këtu kemi numër shumë më të madh elektronesh. Përderisa tek lidhja kovalente kontribues ishin dy atome dhe qifti elektronik përqendrohej kryesisht në hapsirën ndërmjet dy joneve, tek lidhja metalike numri i atomeve është shumë më i madh dhe si rezultat, elektronet e kolektivizuara lëvizin lirshëm për gjatë tërë hapsirës së joneve.



Lidhja e Hidrogjenit[4]
[Redakto | Redakto nëpërmjet kodit]Atomi i Hidrogjenit në shtresën e vet elektronike ka vetëm një elektron, dhe logjikisht duhet pritur që ai mund të lidhet edhe me një atom tjetër të ngjashëm përmes lidhjes kovalente. Mirëpo, ka raste kur atomi i Hidrogjenit krijon lidhje me më shumë se një atom. Zakonisht, nën kushte të caktuara një atom i Hidrogjenit lidhet më dy atome të tjera me forca përafërsisht të mëdha. Lidhja e tillë njihet si lidhje e Hidrogjenit ose si lidhje urë e Hidrogjenit me energji të lidhjes rreth 0,1 eV. Supozohet se në të shumtën e rasteve ky tip i lidhjes është i karakterit jonik si dhe formohet me atome të cilat kanë elektronegativitet të madh, si p.sh. F, O, N. Për rastin kur lidhja është plotësisht e karakterit jonik, atomi i Hidrogjenit humb elektronin i cili kalon në një atom tjetër të lidhjes, kurse protoni i vetmuar është përgjegjës për krijimin e lidhjes së Hidrogjenit. Dimenzionet e vogla të protonit bëjnë që ai të ketë vetëm dy atome fqinjë, pasi që këto atome do të vendosen aq afër protonit bëjnë që ai të ketë vetëm dy atome fqinjë, pasi që këto atome do vendosen aq afër protonit të Hidrogjenit nuk do të ketë mundësi të vendosjes së atomeve të tjera.


Një pjesë më madhe e bashkëveprimit mes molekulave të ujit kryhet përmes lidhjes së Hidrogjenit, po ashtu kjo lidhje së bashku me bashkëveprimin elektrostatik tërheqës të dipoleve është përgjegjës për më shumë veti fizike të ujit dhe akullit (anomalia e ujit). Lidhja e Hidrogjenit ndikon që molekulat proteinike të mos kenë shpërndarje të rregullt gjeometrike, si dhe është shumë e rëndësishme në gjenetikën molekulare sepse lidhë dy vargje të DNA-së.
Referimet
[Redakto | Redakto nëpërmjet kodit]- https://en.wikipedia.org/wiki/Van_der_Waals_force
- http://www.chemguide.co.uk/atoms/bonding/ionic.html
- http://chemwiki.ucdavis.edu/Theoretical_Chemistry/Chemical_Bonding/General_Principles/Covalent_Bonds Arkivuar 12 qershor 2014 tek Wayback Machine
- http://www.elmhurst.edu/~chm/vchembook/161Ahydrogenbond.html Arkivuar 8 qershor 2014 tek Wayback Machine
