Termodinamika
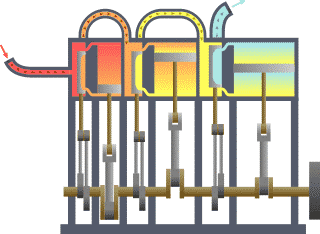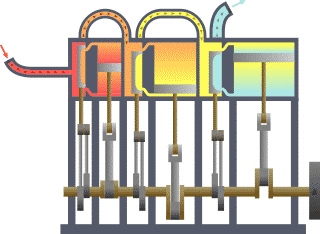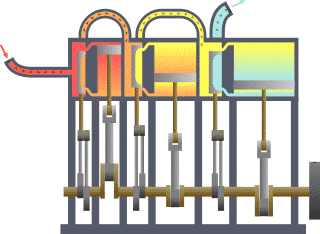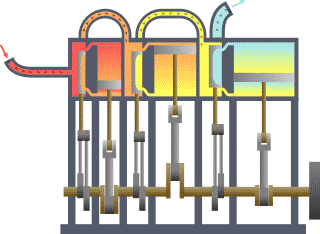
Termodinamika (prej gj.greke thermos që do të thotë nxehtësi dhe dynamis që do të thotë energji/fuqi) është degë e fizikës që studion ndikimin e ndërrimit të temperaturës,shtypjes dhe vëllimit në sistemet fizike të madhësisë mikroskopike përmes analizimit të lëvizjeve kolektive të grimcave të tyre, duke përdorur statistikën. Përafësisht, nxehtësi do të thotë “energji në tranzit (lëvizje)” dhe dinamika ka të bëj me “lëvizje/transferim”; kështu që në thelb termodinamika studion lëvizjen e energjisë dhe se si energjia shndërrohet.
Përmbledhje
[Redakto | Redakto nëpërmjet kodit]Pika e fillimit për çdo faktor termodinamik janë ligjet e termodinamikës, të cilat theksojnë se energjia mund të transferohet/shndërrohet në mes sistemeve fizike, në trajtë të nxehtësisë ose punës. Ato gjithashtu thonë se ekziston një madhësi e quajtur entropi, e cila mund të përcaktohet për çdo sistem. Në termodinamikë, bashkëveprimet mes ansambleve të mëdha të objekteve janë studiuar dhe kategorizuar. Kryesore me këto janë konceptet e sistemit dhe rrethinës. Një sistem është i përbërë prej grimcave, lëvizja mesatare e të cilave përcakton vetitë, tëcilat siç duhet janë të lidhura me njëra tjetrën me ekuacionin e gjendjes. Vetitë mund të bashkohen e të shprehin energjinë e brendshme, dhe potencialet termodinamike përdoren për të caktuar konditat/kushtet për ekuilibër dhe procese spontane.
Me këto mjete, termodinamika përshkruan se si sistemi i përgjigjet ndërrimeve në rrethinë. Këto mund të aplikohen gjerësisht në tema të ndryshme të shkencave dhe teknologjive si: motorët, kalimet fazore, reaksionet kimike, fenomenin e transportit, madje edhe në vrimat e zeza. Përfundimet e termodinamikës janë esenciale për fushat e tjera të fizikës, kimisë, inxhinerisë kimike, citologjisë, biomedicinës inxhinerike etj.
Historik i zhvillimit të termodinamikës
[Redakto | Redakto nëpërmjet kodit]
Një histori e shkurtër e termodinamikës fillon me shkencëtarin gjerman Otto von Guericke, i cili në vitin 1650 dizajnoi dhe ndërtoi pompën e parë të vakumit në botë dhe krijoi vakumin e parë ndonjëherë në botë i njohur si hemisferat e Magdeburg – ut. Ai u shtyt ta bëjë vakumin/boshllëkun në mënyrë që ta përgënjeshtrojë/hedh poshtë supozimin e gabuar e të mbajtur një kohë të gjatë të Aristotelit se “Natyra e urren vakumin”. Pak kohë më pas fizkani dhe kimisti irlandez, Robert Boyle mësoi për konstruktimet e Guericke – s dhe më 1656 në koordinim me shkencëtarin anglez Robert Hooke, ndërtoi një pompë ajri. Me këtë pompë, Boyle dhe Hooke vërejtën korelacionin shtypje – temperaturë – vëllim. Në këtë kohë, ligji për gazin ideal u formulua. Më pas më 1679, bazuar në të njejtat koncepte, një koleg i Robert Boyle – it i quajtur Denis Papin konstruktoi një tretës të eshtrave/“bone digester” që është një enë e mbyllur fort me një kapak të përshtatshëm, që e kufizon avullin të dali derisa të nxirret presion i lartë.
Konstruktimet e mëvonshme implementuan një valvulë që lëshonte avullin, e cila e ruante makinën prej eksplodimit. Duke e shikuar valvulën ritmikisht që shkonte posht – lart, Papini e konceptoi/mendoi idenë e motorit/makinës me piston dhe cilindër. Sidoqoftë ai nuk e konstruktoi atë. Megjithatë, më 1697, i bazuar në dizajnet/planet e Papin – it inxhinieri/makinisti Thomas Savery ndërtoi makinën e parë. Edhepse këto makinat e hershme ishin të pa takt/papërpunuara dhe jo efikase, ato tërhoqën vëmendjen e shkencëtarëve kryesorë të kohës. Një shkencëtar i tillë ishte, Sadi Carnot, “babai i termodinamikës”, i cili më 1824 botoi veprën “Reflections on the motive power of fire” (Reflektim/pasqyrim në fuqinë lëvizëse të zjarrit), një ligjërim për nxehtësinë, fuqinë, dhe efikasitetin e makinave. Kjo shënon fillimin e termodinamikës si shkencë moderne.
Termodinamika klasike
[Redakto | Redakto nëpërmjet kodit]Termodinamika klasike është variacion i termodinamikës, i viteve të hershme të 1880, që u mor me gjendjet termodinamike, dhe vetitë si energjia, puna dhe nxehtësia dhe me ligjet e termodinamikës, por të gjithave u mungonte interpretimi atomik. Në formë paraprake, termodinamika klasike buron prej fizikanit Robert Boyle, i cili më 1662 theksoi se shtypja/presioni p për një sasi të dhënë gazi ndryshon anasjelltas me vëllimin V në temperaturë konstante; forma e ekuacionit pV = k, konstante. Prej këtu, një ngjasim i termo – shkencave filloi të zhvillohet me konstruksionin e makinës së parë me avull/atmosferik në Angli nga Thomas Savery në 1697 dhe Thomas Newcomen në 1712. Ligji i parë dhe i dytë dolën në të njejtën kohë më 1850, së pari nga punimet e William Rankine, Rudolf Clausius dhe William Thomson (Lord Kelvin). Në fund – Lordi Kelvin e sajoi termin termodinamikë më 1849 në botimin e “An account of Carnot’s theory of the motive power of heat”. Libri i parë i mësimit të termodinamikës u shkrua më 1859 nga William Rankine, një qytetar dhe profesor i inxhinerisë mekanike në Universitetin e Glasgow – it.
Termodinamika statistike
[Redakto | Redakto nëpërmjet kodit]Me zhvillimin e teorisë te ular. Kjo fushë u quajt termodinamikë statistike, e cila mund të mendohet si një urë lidhëse në mes parametrave makro dhe mikroskopikë të sistemit. Esencialisht, statistika termodinamike është një afrim i termodinamikës me statistikën mekanike, e cila përqendrohet derivimin/rrjedhojën e rezultateve makroskopike prej fillesave të para. Mund t’i kundërvihet parardhësit historik termodinamikës fenomenale, e cila jep përshkrime shkencore të fenomeneve duke iu shmangur detaleve mikroskopike. Qasja statistike është të përfitojë të gjitha parametrat makroskopikë (temperatura, vëllimi, shtypja, entropia etj.) prej parametrave të grimcave përbërëse në lëvizje dhe bashkëveprimit të tyre (duke përfshirë edhe fenomenin/dukurinë e kuanteve). Është demonstruar mjaft e suksesshme, prandaj përdoret shpesh.
Termodinamika kimike
[Redakto | Redakto nëpërmjet kodit]Termodinamika kimike studion raportin e nxehtësisë me reaksionet kimike ose me ndryshimet fizike të gjendjes pa kufizimin e ligjeve të termodinamikës. Gjatë viteve 1873 – 76 matematikani – fizikani amerikan Wiilard Gibbs botoi tre teori/letra më e famshmja ishte On the Equilibrum of Heterogeneous Substances, në të cilën ai tregoi se si proceset termodinamike mund të analizohen grafikisht, duke studiuar energjinë, entropinë, vëllimin, temperaturën dhe shtypjen e sistemit termodinamik, në atë mënyrë që të kuptohet se a do të ndodhte procesi spontanisht. Gjatë viteve të hershme të shek.XX, kimistë si Gilbert Lewis, Merle Randall dhe E. A. Guggenheim filluan të aplikojnë metodat matematike të Gibbs – it për të analizuar proceset kimike.
Sistemet termodinamike
[Redakto | Redakto nëpërmjet kodit]Një koncept i rëndësishëm në termodinamikë është “sistemi”. Sistemi është një regjion i universit nën studim. Sistemi është i ndarë prej pjesës tjetër të universit me kufi, i cili mund të jetë i imagjinuar ose jo, por, i cili me marrëveshje zë një vëllim të përcaktuar (i ka kufijtë e caktuar). Ndryshimet e mundshme në punë, nxehtësi ose shkëmbim të materies mes sistemit dhe rrethinës bëhet rreth këtij kufiri. Janë pesë kategori dominuese sistemesh:
- Sistemet e izoluara – materia dhe energjia mund të mos e kalojnë kufirin.
- Sistemet adiabatike – nxehtësia s’e kalon kufirin.
- Sistemet diatermike – nxehtësia e kalon kufirin.
- Sistemet e mbyllura – materia s’e kalon kufirin.
- Sistemet e hapura – nxehtësia, puna, materia mund ta kalojnë kufirn.
Sistem quajmë një grup elementesh të veçanta që kryejnë një funksion të përbashkët. Për sistemet e izoluara, sa më tepër që koha kalon, diferencat në sistem kanë tendencë të eleminohen: shtypja dhe temperatura priren të barazohen, në atë mënyrë që densiteti ndryshon. Një sistem tek i cili të gjitha proceset e barazuese praktikisht kanë përfunduar, konsiderohet të jetë në ekuilibër termodinamikë.
Në ekuilibër termodinamik, parametrat e sistemit sipas përcaktimit, të pandryshueshme në kohë. Sistemet në ekuilibër janë shumë më të thjeshtë dhe më të lehtë për t’i kuptuar se sa sistemet që nuk janë në ekuilibër. Shpesh, kur të analizohet një proces termodinamik, mund të supozohet se secila gjendje e ndërmjetme në proces është në ekuilibër. Kjo në mënyrë të konsiderueshme na e lehtëson situatën. Proceset termodinamike të cilat zhvillohen aq ngadalë sa të lejojnë që secili hap i ndërmjetëm të jetë në gjendje ekuilibruese është e thënë të jenë procese reverzibile.
Parametrat termodinamik
[Redakto | Redakto nëpërmjet kodit]Koncepti qëndror në termodinamikë është energjia, aftësia/kapaciteti për të kryer punë. Siç u përcaktua nga ligji i parë, energjia e përgjithshme në sistem dhe në rrethinë konservohen/ruhen. Mund të transferohen në trup ose përmes nxehtësisë, ngjeshjës ose shtimit të materies, ose mund të ekstraktohet/nxirret nga trupi ose me ftohje, zgjerim, ose nxjerrje të materies. Si krahasim në mekanikë, transferi i energjisë është rezultat i forcës që shkakton zhvendosjen, prodhimi i të dyjave, është sasia e enrgjisë së transferuar. Në mënyrë të ngjajshme, sistemet termodinamike mund të mendohen se transferojnë energjinë si një rezultat i një force të përgjithësuar që shkakton një zhvendosje të përgjithësuar, prodhimi i të dyjave është sasia e energjisë së transferuar. Këto çifte forcë – zhvendosje termodinamike njihen si ndryshore të konjuguara/bashkuara. Ndryshoret e konjuguara më të shpeshta në termodinamikë janë: shtypje – vëllim (parametra mekanikë), temperaturë – entropi, dhe potenciali kimik – numri i grimcave (parametra material).
Instrumentet termodinamike
[Redakto | Redakto nëpërmjet kodit]Janë dy lloje të instrumenteve termodinamike, njehsori (meter) dhe rezervuari (reservoir). Një njehsor termodinamikë është çdo paisje e cila mat çfarëdo parametri të një sistemi termodinamik. Në disa raste, në fakt parametri termodinamik përcaktohet nën kushtet e një instrumenti matës të idealizuar. ligji i zeros (zeroth law) thotë se nëse dy trupa janë në ekuilbër termik me një trup të tretë, atherë ata dy trupa janë në ekulibër termik me njëri tjetrin. Ky parim, si e përmendi James Maxwell në vitin 1872, pohon se është e mundshme t’i matet temperatura. Një termometër ideal është një mostër/shembull e në gazi ideal në shtypje konstante. Prej ligjit për gazin ideal pV = nRT, vëllimi i një mostre të tillë mund të përdoret si indikator i temperaturës; në këtë mënyrë e përcakton temperaturën. Edhepse shtypja është e përcaktuar/definuar mekanikisht, paisja për matjen e shtypjes, e quajtur barometër mund të konstruktohet prej një mostre të gazit ideal të mbajtur në temperaturë konstante. Kalorimetri është paisje e cila e mat dhe e përcakton/karakterizon energjinë e brendshme të sistemit.
Një rezervuar termodinamik është një sistem i cili është aq i madh sa nuk i ndryshon dukshëm parametrat e gjendjes kur është në kontakt me sistemin pilot/provues. Përdoret për të vënë një vlerë të caktuar/veçantë parametrit të gjendjes mbi sistemin. Për ilustrim, rezervuari i shtypjes është një sistem me një shtypje të caktuar, i cili ngarkon me atë shtypje cilindo sistem provues që është i lidhur mekanikisht me të. Atmosfera e tokës shpesh përdoret si rezervuar i shtypjes.
Gjendjet termodinamike
[Redakto | Redakto nëpërmjet kodit]Kur një sistem është në ekuilibër në kushte/kondita të dhëna, është thënë se e ka të përcaktuar/karakterizuar gjendjen. Gjendja e sistemit mund të përshkruhet si një numër ekstensiv dhe intensiv të variableve/ndryshoreve. Parametrat e sistemit mund të përshkruhen me anë të një ekuacioni të gjendjes i cili specifikon mardhëniet e këtyre ndryshoreve. Gjendja mund të mendohet si një përshkrim sasior i çastit të sistemit me një numër të fiksuar/caktuar variablash/ndryshoresh të mbajtura konstante.
Proceset termodinamike
[Redakto | Redakto nëpërmjet kodit]Procesi termodinamik mund të definohet si evulucion/zhvillim energjetik i sistemit termodinamik i cili rrjedh/kalon prej gjendjes iniciale/fillestare tek gjendja finale/përfundimtare. Në mënyrë tipike, secili proces termodinamik ndryshon prej proceseve të tjera, në karakter energjetik, sipas cilit parametër, temperaturës, vëllimit, shtypjes etj, mbahen konstantë. Veç kësaj, është me rëndësi t’i grupojmë këto procese në çifte, në të cilën secila ndryshore e cila mbahet konstant është një antarë i një çifti të konjuguar. Gjashtë proceset termodinamike më të shpeshta janë paraqitur më poshtë:
- Procesi izobarik ndodh në shtypje konstante.
- Procesi izohorik (izometrik/izovolumetrik) ndodh në vëllim konstant.
- Procesi izotermik ndodh në temperaturë konstante.
- Procesi izotropik ndodh në entropi konstante.
- Procesi izoentalpik ndodh në entalpi konstante.
- Procesi adiabatik ndodh pa humbje dhe marrje/pranim të nxehtësisë.
Ligjet e termodinamikës
[Redakto | Redakto nëpërmjet kodit]Termodinamika mbështetet në katër ligje përgjithësisht të vlefshme, kur ato zbatohen në sisteme që ju binden kufizimeve të tyre. Në përshkrimet e ndryshme teorike të termodinamikës këto ligje shprehen në forma të ndryshme por formulimi më i drejtë i tyre do të ishte si më poshtë vijon:
- Ligji zero i termodinamikës: Nëse dy sisteme termodinamike, secili prej tyre është në ekuilibër termik me një sistem të tretë, atëherë këto dy sisteme janë në ekuilibër termik me njëri tjetrin.
Ky pohim tregon që ekuilibri termik është një relacion ekuivalent në sistemet termodinamike që merren në konsideratë. Sistemet thuhet se janë në ekuilibër kur ndryshimet më të vogla të rastësishme që pësojnë sistemet midis tyre (p.sh nga lëvizja Brownian) nuk çojnë në ndryshimin neto të energjisë. Ky ligj zbatohet gjithmonë për ndryshimet e temperaturës. Ndërkaq, nqs duhet të themi se dy trupa kanë të njëjtën temperaturë, nuk është e nevojshme ti vendosim në kontakt me njëri tjetrin dhe të masim çdo ndryshim të dukshëm të cilësive të tyre me kalimin e kohës. Ligji na ndihmon të kemi një përkufizim empirik të temperaturës dhe të ndërtojmë termometra për matjen e saj.
Ligji zero në fillim nuk u emërtua si ligj i termodinamikës, sepse ekuilibri që ishte baza e tij u përfshi në ligje të tjera. Ligji i parë, i dytë dhe i tretë u pohuan si më të rëndësishmit dhe u pranuan menjëherë nga komuniteti i fizikës. Por menjëhera sapo u kuptua rëndësia e ligjit në përcaktimin e temperaturës dhe duke qënë se ishte jo praktike të ribëhej rinumërimi i ligjeve të mëparshme ky ligj u numërua si ligji zero i termofdinamikës.
- Ligji i parë i termodinamikës: Energja e brendshme e një sistemi të mbyllur është konstante.
Ligji i parë i termodinamikës shpreh parimin e ruajtjes së energjisë. Ai pohon faktin që energjia mund të transfomohet (të ndryshoj nga një formë në një formë tjetër) por nuk mund të krijohet apo të zhduket.
Ligji i parë zakonisht formulohet duke u shprehur që ndryshimi i energjisë së brendshme në një sistem të mbyllur termodinamik është i barabartë me diferencën midis nxehtësisë që i jepet sistemit dhe sasisë së punës që kryen sistemi në mjedisin rrethues. Një rëndësi të madhe ka të theksohet që energjia e brendhme është një gjendje e sistemit (shih gjendjen Termodinamike) ku nxehtësia dhe puna e kryer e ndryshojnë gjendjen fillestare të sistemit. Me fjalë të tjera, një ndryshim i energjisë së brendshme të sistemit mund të ndodhë nga kombinimi në total i nxehtësisë së shtuar apo të larguar nga sistemi ose puna e kryer nga sistemi në mjedis apo nga mjedisi mbi sistem. Mënyra ose rruga që përshkruan sistemi për të ndryshuar enegjinë e brendshme nuk ndikon në këtë ndryshim të energjisë.
- Ligji i dytë i termodinamikës: Nxehtësia nuk kalon në mënyrë spontane nga një vend i ftohtë në një vend të ngrohtë.
Ligji i dytë i termodinamikës është një shprehje e parimit universal të vëzhgimeve të bëra të dekompozimit të natyrës. Ky ligj shpreh faktin që me kalimin e kohës diferencat e temperaturës, presionit dhe potencialit kimik tentojnë të shkatërrojnë një sistem fizik që është i izoluar nga pjesa e jashtme e botës. Entropia është një matës sa sa i madh është progresi i këtij proçesi. Entropia e një sistemi të izoluar që nuk është në ekuilibër do të tentoj të rritet me kalimin e kohës duk arritur një vlerë maksimale kur arrin në ekuilibër. Megjithatë parimet që udhëheqin sistemet që janë larg ekuilibrit të tyre janë akoma të diskutueshme. Një nga parimet është principi i prodhimit të maksimumit të entropisë. Ky parim pohon faktin që sistemet jo në ekuilbër sillen në mënyrë të tillë duke rritur në maksimum prodhimin e entropisë.
Në termodinamikën klasike ligji i dytë është postulati bazë i zbatueshëm në çdo sistem ku përfshihet transferimi i energjisë termike; në termodinamikën statistike ligji i dytë është pasojë e presupozimeve të rastisë në kaosin molekular. Ka disa variante të ligjit të dytë, por të gjithë kanë të njëjtn efekt i cili shpjegon fenomenin e pakthyeshmërisë së natyrës.
- Ligji i tretë i termodinamikës: Kur një sistem i afrohet zeros absolute të gjitha proçeset ndërpriten dhe entropia e sistemit arrin vlerën minimale.
Ligji i tretë i termodinamikës është një ligj statistikor i natyrës në lidhje me entropinë dhe pamundshmërinë e arritjes së temperaturës zero absolute. Ky ligj siguron një pikë referuese për përcaktimin e entropisë. Entropia e përcaktuar në këtë pikë është entropia absolute. Përcaktime të tjera alternativë janë "entropia e të gjithë sistemeve dhe të gjitha gjendjet e sistemit kanë vlerën më të vogël në zeron absolute" ose shprehja tjetër "është e pamundur të arrihet vlera absolute me një numër të caktuar proçesesh".
Zeroja absolute në të cilën të gjitha aktivitetet do të ndalonin nqs do të ishte e mundur të arrihej, është −273.15 °C (gradë Celsius), ose −459.67 °F (gradë Fahrenheit), ose 0°K (Kelvin), or 0° R (gradë Rankine).
Potencialet termodinamike
[Redakto | Redakto nëpërmjet kodit]Siç mund të nxirret prej ekuacionit të energjisë së balancuar/ekuilibruar në një sistem termodinamik ekzistojnë madhësi enrgjetike të quajtura potenciale termodinamike, që matëse sasiore/kuantative e energjisë së ruajtur në një sistem. Katër potencialet më të njohura të potencialeve janë:
| Emri | Simboli | Formula | Variablat natyrore |
|---|---|---|---|
| Energjia e brendshme | |||
| Energjia e lirë e Helmholtzit | , | ||
| Entalpia | |||
| Energjia e lirë e Gibbsit | |||
| Energjia potenciale e Grandit | , |
Potencialet përdoren për të matur ndërrimet e energjisë në sistem ashtu që ato zhvillohen prej gjendjes fillestare te gjendja përfundimtare/finale. Përdorimi i potencialeve varet prej përmbajtjes së sistemit, si temperatura ose shtypja konstante. Energjia e brendshme është energjia e brendshme e sistemit, entalpia është energjia e brendshme plus energjia e që lidhet me punën presion-vëllim, dhe energjitë e lira të Helmholtz – it dhe Gibbs – it janë energji në dispozicion në sistem që përdoren për të kryer punë kur temperatura dhe vëllimi ose shtypja dhe temperatura janë të pandryshuara.
Degët e termodinamikës
[Redakto | Redakto nëpërmjet kodit]Degët e termodinamikës janë:
- Termodinamika atmosferike
- Termodinamika e çekuilibrimeve
- Termodinamika biologjike
- Termodinamika e fenomeneve
- Termodinamika e vrimave të zeza
- Psikodinamika
- Termodinamika kimike
- Termodinamika kuantike
- Termodinamika klasike
- Termodinamika statistike
- Termodinamika e ekulibrimeve
Temperatura
[Redakto | Redakto nëpërmjet kodit]Temperatura matet me shkalle te celzius, kelvin apo me shkalle te Farenheit-i.Jane vlera numerike qe bejne lidhje e ketyre njesive. Me rendesi është për tu theksuar njesija kelvin (K) me qe është e lidhur me te ashtuquajtur temperature absolute te trupit dhe numrin -273. Kjo vlere e temperatures shenon zeron absolute e cila nuk (shum veshtire munde) te arrihet. Ja pse: Si qe thame levizja e grimcave është ajo qe shkakton nxektesise e trupit, e cila qe te zbret aq shum sa qe temperatura e tij te jete ne vleren e zeros absolute
Parimet e Termodinamikës
[Redakto | Redakto nëpërmjet kodit]Jane parime te termodinamikes te cilat zbatohen ne te gjitha lemite e zbatimeve te energjise por edhe ne ligjet e levizjeve sociologjike, bilogjike, psikologjike dhe informative.
- Parimi i parë thot qe sasija e nxëhtësise që futet në një sistem shkon ne rritjen e energjisë së brendeshme të sistemit dhe në kryerjen e një punë përkundër ambjenit perreth.
- Parimi i dytë apo ligji i entropisë thotë që në sistemet e izoluara entrpia e tij është gjithmon në rritje. Nderrimi i entropisë së një sistemi definohet si shumë e tërsishme apo integral i ndërrimeve të nxehtësise pjestuar me temperaturen e sistemit ne shqyrtim.
Kur theksojme entropine (shenohet me S, aludojme ne ndrrimin e saje por duke filluar nga vlera e saje zero.( E njeta gje vlen edhe me definimin e potencialit apo distances). Me ndërrimin e entopisë se sistemit të caktuar analizohet kahja e levizjes së proceseve fizike, kimike , biologjike etj. Kur ndërrimi i entropise(delta S) është me i madhe se zero procesi është irreverzibil ( i pa kethyeshem), kur nderrimi është zero procesi është reverzibil dhe kur ndrrimi ne fjale ka vleren me i vogel se zero procesi është i pamundur. Ketu shihet roli i gjithëanshem i ligjit të ndërrimit të enropise apo parimit te dytë të termodinamikes. Më anë të tij parashihen levizjet e proceseve ne shkence shoqeri dhe kahet rrjedhjes se informacionece.Entropia në aspektin informative definohet si shkalle e crregullesise. Crregullsia apo kaosi dhe rregullesia janë procese fundamentale në të gjitha lemite e hulumtive. Të themi psh. qe Universi si sistem i izoluar ka nje entropi ne rritje për cka dihet qe ai zgjerohet ne menyre te pakethyeshme. Parimi i trete ne fakt quhet parimi zero(0) i termodinamikes.Keto nuk po e trajtojme por vetem te themi qe ai ndihmone ne definimin e teperatures dhe për ta kuptuar shum lehte, te mendojme situaten si vijon. Kur dy madhesi janë te njejta me nje madhesi te trete atehere ato janë te njejta edhe me njera tjetren. Keto që u trajtuan me sipër i përkasin termodinamikes fenomenologjike. Përndryshe ekziston edhe termodinamika statistikore qe trajtohet me anë të teorisë së probabilitetit e cila është jashte fushes se veshtrimit te paraqitur në këtë shkrim.



















