Bateria

Bateria është mjet i cili ben akumulimin e energjisë elektrike. Përdoret si burim energjie elektrike në pajisje dhe raste, të cilat për nga natyra e funksionimit të tyre, ose për arsye krijimi lehtësirash në përdorim, nuk ushqehen nga rrjeti i energjisë elektrike. Këto pajisje mund të jenë të vogla (radio portative, TV portativë, ora dore, lodra elektronike, aparate fotografike, videokamera, riprodhues portativë muzike, aparate matës, etj.), të mesme (kompjuter, magnetofon, mini-televizor) dhe të mëdha (makina, mjete pune, instrumente muzikore dhe të tjera).
Historia
[Redakto | Redakto nëpërmjet kodit]Benxhamin Franklin e përdori për herë të parë termin "bateri" në 1749 kur ai po bënte eksperimente me energjinë elektrike duke përdorur një grup kondensatorësh kavanoz Lejden të lidhur. [1] Franklin grupoi një numër kavanozësh në atë që ai e përshkroi si "bateri", duke përdorur termin ushtarak për armët që funksionojnë së bashku.[2] Duke shtuar numrin e kavanozave mbajtës, mund të ruhej një ngarkesë më e madhe dhe më shumë energji do të ishte në dispozicion për përdorim.
Fizikanti italian Aleksandër Volta ndërtoi dhe përshkroi baterinë e parë elektrokimike, pilën voltaike, në 1800.[3] Kjo ishte një pirg pllakash bakri dhe zinku, të ndara nga disqe letre të njomura me shëllirë, që mund të prodhonin një rrymë të qëndrueshme për një kohë të konsiderueshme. Volta nuk e kuptoi që tensioni ishte për shkak të reaksioneve kimike. Ai mendonte se bateritë e tij ishin një burim i pashtershëm energjie[4] dhe se efektet e korrozionit në elektroda ishin thjesht një efekt anësor i bezdisshëm, dhe jo një pasojë e pashmangshme e funksionimit të tyre, siç tregoi Majkëll Faradej në 1834.[5]


Megjithëse bateritë e hershme kishin vlerë të madhe për qëllime eksperimentale, në praktikë tensionet e tyre luhateshin dhe ato nuk mund të siguronin një rrymë të madhe për një periudhë të qëndrueshme. Pila Daniell, e shpikur në 1836 nga kimisti britanik Xhon Frederik Daniell, ishte burimi i parë praktik i energjisë elektrike, duke u bërë një standard i industrisë dhe duke parë një adoptim të gjerë si një burim energjie për rrjetet e telegrafëve elektrikë.[6] Ai përbëhej nga një enë bakri e mbushur me një tretësirë të sulfatit të bakrit, në të cilën ishte zhytur një enë balte të paglazuruar të mbushur me acid sulfurik dhe një elektrodë zinku.[7]
Këto pila të njoma përdorën elektrolite të lëngshme, të cilat ishin të prirura për rrjedhje dhe derdhje nëse nuk trajtoheshin siç duhej. Shumë përdorën kavanoza qelqi për të mbajtur përbërësit e tyre, gjë që i bëri ata të brishtë dhe shpesh herë të rrezikshëm. Këto karakteristika i bënë pilat e njoma të papërshtatshme për pajisjet portative. Afër fundit të shekullit të nëntëmbëdhjetë, shpikja e baterive me qeliza të thata, të cilat zëvendësuan elektrolitin e lëngshëm me një pastë, i bënë pajisjet elektrike portative praktike.[8]
Bateritë në pajisjet me tub vakum përdornin historikisht një pilë të njomë për baterinë "A" (për të siguruar energji për filamentin) dhe një pilë të thatë për baterinë "B" (për të siguruar tensionin e pllakës).
Principi i funksionimit
[Redakto | Redakto nëpërmjet kodit]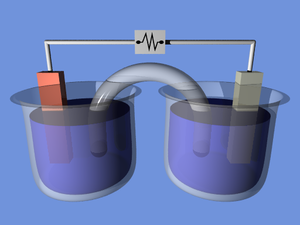
Bateritë konvertojnë energji kimike direkt në energji elektrike. Një bateri përbëhet nga disa qeliza voltaike. Secila qelizë përbëhet nga dy gjysma të lidhura në seri nga një përçues elektrolit që përmban anione dhe katione. Njëra gjysmë përfshinë elektrolitën dhe elektrodën negative, elektronda në të cilën anionet (jonet negative) migrojnë; gjysma tjetër përfshinë elektrolitën dhe elektrodën pozitive në të cilën kationet (jonet pozitive) migrojnë. Kationet redukohen (elektronet janë pjesëmarrëse) në katodë gjatë ngarkimit, derisa anionet oksidohen (elektronet fshihen) në anodë gjatë shkarkimit.[9] Elektrodat nuk e prekin njëra-tjetrën, por janë elektrikisht të lidhura nga elektrolita. Disa qeliza përdorin elektrolita të ndryshme për secilën gjysmë. Ndarësi i lejon jonët të rrjedhin midis gjysmave të qelizës, por parandalon përzierjen e elektrolitës.
Secila gjysmë qelize ka një forcë elektromotore, të përcaktuar nga aftësia e saj për të lëvizur rrymën elektrike nga brendësia në jashtësi të qelizës. Forca përfundimtare e qelizës është ndryshimi në mes të dy gjysmave të saj. Kështu, nëse elektroda ka FEM dhe , atëherë FEM përfundimtare ; me fjalë të tjera, FEM përfundimtare është ndryshimi në mes të potencialeve të reduktuara dhe gjysmë reaksioneve.[10]
Forca elektrike lëvizës ose rreth terminalit të një qelize njihet si tension terminal (ndryshim) dhe matet në volt.[11] Tensioni terminal i qelizës që nuk është as i ngarkuar as i shkarkuar quhet tension i qarkut të hapur dhe është i barabartë me FEM të qelizës. Për shkak të rezistencës së brendshme,[12] tensioni terminal i qelizës që është e shkarkuar është më e vogël në madhësi sesa tensioni i qarkut të hapur dhe tensioni terminal i një qelize që është e nagkuar e tejkalon tensionin e qarkut të hapur.[13]
Një qelizë ideale ka rezistencën e brendshme të papërfillshme, kështu që do të vazhdojë ta mbajë tensionin terminal konstant të derisa të dobësohet, pastaj bjen të zero. Nëse qeliza e tillë mban tensionin prej 1.5 volt dhe ka një ngarkesë prej 1 kulon, në shkarkimin e plotë do të paraqet 1.5 xhaul pune.[11] Në qelizat aktuale, rezistenca e brendshme rritet nën shkarkim, dhe tensioni i qarkut të hapur bien nën shkarkim. Nëse tensioni dhe rezistenca janë të kurdisuar kundër kohës, grafi rezultues është një kurbë; forma e kurbes ndryshon bazuar në marrëveshjet kimike dhe internale.
Tensioni i zhvilluar përreth terminaleve të qelizës varet nga lidhja e energjisë në reaksionet kimike të elektrodave dhe elektroliteve të tij. Qelizat alkaline dhe zink-karbonike kanë kimi të ndryshme, por përafërsisht të njëjtën FEM të 1.5 voltësh; ashtu edhe qelizat e NiCd dhe NiMH kanë kimi të ndryshme, por afërsisht të njëjtën FEM prej 1.2 voltësh.[14] Potenciai i lartë elektrokimik ndryshon në reaksionet e përbërësve të litiumit jep qeliva të litiumit me FEM prej 3 voltësh ose më shumë.[15]
Efektet negative te baterive
[Redakto | Redakto nëpërmjet kodit]Baterite krahas perdorimit te tyre dhe aneve pozitive kane edhe disa efekte negative te tyre neqoftese hidhen si mbeturina. Per shembull baterite me plumb dhe Kadium .Për njerëzit, plumbi dhe kadiumi mund të merren vetëm nga gëlltitje apo frymemarrje nqs ato jane ne ajer . Merkuri eshte nje tjetër metal i dëmshem qe mund edhe të thithet nëpërmjet lëkurës , megjithëse përdorimi i këtij metali në bateri ka rënë në masë të madhe për shkak të ligjeve dhe rregulloreve që jane vënë në vend për të reduktuar përmbajtjen e saj .
Këto substanca të dëmshme përshkojnë në ujë, tokë dhe ne ujëra nëntokësore përmes depove , sipërfaqes dhe clirojne ajer toksik kur digjen. Për më tepër, kadiumi merret lehtë nga rrënjët e bimëve dhe grumbullohet në fruta, perime dhe ne bar. Uji i papastër dhe bimët nga ana e tyre konsumohen nga kafshët dhe qeniet njerëzore , të cilët pastaj bien pre e një mori efektesh dhe sëmundjesh. Studimet tregojnë se keto substanca shkaktojne, të përziera ,jargëzim te tepruar , dhimbje te barkut , mëlçisë dhe deme ne veshka , acarim të lëkurës , dhimbje koke , astem , nervozizem, ul IQ(koeficientin e intelligjences) te fëmijët dhe nganjëherë madje shkakton kancer qe mund të merret nga ekspozimi ndaj metaleve të tilla për një periudhë kohe të gjate. Përveç kësaj , kaliumi, nqs perhapet , mund të shkaktojë djegie të rënda kimike duke ndikuar te sytë dhe ne lëkurë. Gropat me mbeturina te baterive gjithashtu gjenerojnë gazin metan që çon në efektin serë dhe shkakton ndryshime globale klimatike .
Kategoritë dhe llojet e baterive
[Redakto | Redakto nëpërmjet kodit]
Bateritë klasifikohen në primare dhe sekondare.
- Bateritë primare në mënyrë të pakthyeshme transformojnë energjinë kimike në energji elektrike. Kur furnizimi i reaktantëve është i dobësuar, enrgjia nuk mund të kthehet lehtë në bateri.[16]
- Bateritë sekondare mund të ri-ngarkohen; kjo do të thotë se ato mund të kenë reaksionet e tyre kimike duke furnizuar qelizën me energji elektrike, përafërsisht duke e kthyer kompozimin origjinal të tyre.[17]
Disa tipe të bateriva primare që përdoren, për shembull, për qarqet telegrafike, restaurohen për funksionim duke rizëvendësuar elektrodat.[18] Bateritë sekondare nuk janë të ringarkueshme në kohë të caktuar për shkak të shpërndarjes së materialeve aktive, humbjes së elektrolitës dhe korrezionit të brendshëm.
Bateritë primare
[Redakto | Redakto nëpërmjet kodit]Bateritë primare ose qelizat primare mund të prodhojnë rrymë menjëherë. Këto janë më të përdorurat në pajisjet portable që kanë zbrazje të vogël të rrymës, përdoren vetëm me ndërprerje, ose përdoren mjaftueshëm larg nga një burim alternativ, si një qarqe komunikuese ku fuqia elektrike është e mundshme vetëm me ndërprerje. Lirshëm qelizat primare nuk mund të ringarkohen seriozisht, pasi reaksionet kimike nuk janë lehtë të kthyeshme dhe materialet aktive nuk mund të kthehen në formën e tyre origjiniale. Prodhuesit e baterive janë kundër tentimit për rimbushje të qelizave primare. [19]
Në përgjithësi, këto kanë densitet më të lartë energjetik se bateritë e ringarkueshme.[20]
Tipe të ngjashme të këtyre baterive janë bateritë zink-karbon dhe bateritë alkaline.
Bateritë sekondare
[Redakto | Redakto nëpërmjet kodit]Bateritë sekondare, të njohura edhe si qelizat sekondare, ose qelizat e ringarkueshme, duhet të ngarkohen para përdorimit të parë; ato janë zakonisht të mbledhura me materiale aktive në gjendje të pangarkuar. Bateritë e ringarkueshme (ri)ngarkohen përmes rrymës elektrike, e cila kthen reaksionet kimike që ndodhin gjatë shkarkimit/përdorimit. Pajisjet për furnizimin e duhur me rrymë quhen ngarkues.
Forma më e vjetër e baterive të ringarkueshme është bateria plumb-acidike. Kjo teknologji përmban elektrolitë të lëngshme në një enë të panjohur, duke kërkuar që bateria të mbahet lart dhe zona të jetë e mirë-ventiluar për të siguruar shpërndarjen e gazit hidrogjenor që prodhohet gjatë ngarkimit. Bateria plumb-acidike është relativisht e lartë për sasi të energjisë elektrike që mund të mbledh. Kostoja e saj e ulët e prodhimit dhe nivelet e larta të rrymës e bëjnë atë të zakonshme ku kapaciteti i saj (përafërsish 10Ah) është më i rëndësishëm se pesha dhe çështjet e trajtimit. Një aplikim i zakonshëm është në bateritë moderne të makinave, të cilat, në përgjithësei, mund të shpërndajnë një rrymë kulmore prej 450 amperëve.
Llojet e baterive qelizore
[Redakto | Redakto nëpërmjet kodit]Shumë lloje të qelizave elektrokimike janë prodhuar, me dizajne dhe procese të ndryshme kimike, duke përfshirë qelizat galvanike, qelizat elektrolite, qelizat karburante, qelizat rrjedhëse dhe pilat voltaike. [21]
Qeliza e lagshtë
[Redakto | Redakto nëpërmjet kodit]Një qelizë e lagshtë ka elektrolitë të lëngshme. Njihet edhe me emrin qeliza e përmbytur, pasi lëngu mbulon gjithë pjesët e brendshme të saj, ose qeliza e çarë, pasi gazrat e prodhuara gjatë funksionimit mund të dalin në ajër. Qelizat e lagështa janë pararendës i qelizave të thata dhe zakonisht përdoren si mjet mësues për elektrokimi. Ato mund të ndërtohen me furnizime të zakonshme laboratorike, si kupat, për demonstrime se si qelizat elektrokimike punojnë. Një tip i veçantë i qelizave të lagështa të njohura si qelizat e koncentrimit është i rëndësishëm për kuptimin e korrezionit.
Qelizat e lagështa mund të jetë qeliza primare ose sekondare. Fillimisht, të gjitha bateritë primare praktike si qelizat Daniell ndërtoheshin si qelizë e lagështë në formë të tjegullës së xhamit të hapur nga sipër. Lloje të tjera të qelizave të qelizave primare të lagështa janë qeliza Leclanche, qeliza Grove, qeliza kromike acidike, qeliza Clark dhe qeliza Weston.
Qeliza e thatë
[Redakto | Redakto nëpërmjet kodit]
Një qelizë e thatë përdor elektrolitë ngjitëse, me lagështi të mjatueshme për ta lejuar rrymën që të rrjedhë. Ndryshe nga qeliza e lagështë, një qelizë e thatë mund të operojë në çfarëdo drejtimi pa u derdhur, pasi nuk përmban lëng të lirë, duke e bërë atë të përshtatshme për pajisjet portable. Nga krahasimi, qelizat e para të thata ishin tipikisht enë xhami delikate me shufra plumbi që dalin nga hapja e sipërme dhe kërkon trajtim të kujdesshëm për të shmangur rrjedhjen. Bateritë plumb-acidike nuk e arrijnë sigurinë dhe transportueshmërinë e qelizave të thata deri në zhvillimin e baterive xhel.
Një qelizë e thatë e zakonshme është bateri zink-karbonike, nganjëherë të quajtur qeliza Leclanche e thatë, me një tension nominal prej 1.5 voltësh, njëjtë si të bateritë alkaline (pasi të dyjat përdorin kombinimin e njëjtë zink- dioksid mangani).
Një qelizë e thatë e standardizuar përbëhet nga një anodë zinku, zakonisht në formë të një tenxhereje cilindrike, me katodë karbonike në formë të një shufre qendrore. Elektrolita është klorid amonit në formë të një ngjitësi afër anodës së zinkut. Pjesa e mbetur në mes të elektrolitës dhe katodës karbonike është e zënë nga një ngjitës sekondar i përbërë nga kloridi i amonit dhe dioksidi i manganit, që më vonë vepron si depolarizator. Në disa projektime, kloridi i amonuit zëvendësohet nga kloridi i zinkut.
Kripa e shkrirë
[Redakto | Redakto nëpërmjet kodit]Bateritë e kripës së shkrirë janë bateri primare ose sekondare që përdorin kripën e shkrirë si elektrolitë. Ato funksionojnë në temperatura të larta dhe duhet të jenë të izoluara mirë që ta mbajnë nxehtësinë.
Rezerva
[Redakto | Redakto nëpërmjet kodit]Bateria rezervë mund të ruhet e vetme (e paaktivizuar ose pa ndonjë fuqi furnizuese) për një periudhë të gjatë (mbase edhe vjet). Zakonisht projektohet për një jetë shërbyese të shkurtër (sekonda ose minuta) pas një akumulimi të gjatë (vite).
Kapaciteti dhe shkarkimi
[Redakto | Redakto nëpërmjet kodit]
Kapaciteti i një bateri është sasia e ngarkesës elektrike që mund të dorëzojë në një tension. Sa më shumë material elektrodik që ka në një qelizë aq më i madh është kapaciteti i saj. Një qelizë e vogël ka kapacitet më të ulët sesa një qelizë e madhe me kimi të njëjtë, edhe pse ato zhvillohen në të njëjtin tension të qarkut të hapur.[22] Kapaciteti matet në njësi si amper-orë (A h).
Kapaciteti i vlerësuar i një baterie është zakonisht i shprehur si produk i 20 orëve shumëzuar me rrymën që një bateri e re mund ta furnizojë për 20 orë në 20 °C, derisa mbetja e mësipërme spefifikohet si tension terminal për qelizë. Për shembull, një bateri e vlerësuar në 100 Ah mund të dorëzojë 5 A në peridhë prej 20 orëve në temperaturë dhome.
Fraksioni i ngarkesës së ruajtur që një bateri mund të dorëzojë varet nga faktorët shumëzues, përfshirë baterinë kimike, vlerësim në të cilin ngarkesa është e dorëzuar (rrymë), tensioni terminal i kërkuar, periudha e ruajtjes, temperatura e ambientit dhe faktorët tjerë.[22]
Sa më i lartë vlerësimi i shkarkimit, aq më i ulët kapaciteti.[23] Marrëdhënia në mes të rrymës, kohës së shkarkimit dhe kapacitetit për bateritë plumb-acidike është përfarësisht nga ligji i Peukertit:
ku
- është kapaciteti kur shkakrohet në vlerë prej 1 amp.
- është rryma e kaluar nga bateria.
- është sasia e kohës (në orë) që një bateri mund mbështes.
- është konstantë rreth 1.3.
Bateritë që ruhet për një periudhë të gjatë ose që janë shkarkuar në një fraksion të vogël të kapacitetit, humb kapacitet për shkak të prezencës së reksioneve anësore të kthyeshme që konsumojnë mbajtësitë e ngarkesës pa prodhuar rrymë. Ky fenomen është i njohur si vetë-shkarkim i brendshëm. Më tej, kur bateritë ringarkohen, reaksione anësore shtesë mund të ndodhin, duke reduktuar kapacitetin për shkarkimet pasuese. Pas ringarkimit të mjaftueshëm, në esencë i gjithë kapaciteti është i humbur dhe bateria ndalon së prodhuari fuqi.
Shkalla C
[Redakto | Redakto nëpërmjet kodit]Shkalla C është një madhësi e vlerësimit në të cilën një bateri po shkarkohet. Është e përkufizuar si rrymë e shkarkuar pjesëtuar nga kalimi teorik i rrymës nën të cilën bateria do të dorëzoj vlerën nominale të kapacitetit në një orë. Vlera shkarkuese prej 1C do të dorëzojë kapacitetin e vlerësuar të baterisë në 1 orë.[24] Një vlerë shkarkuese prej 2C nënkupton se ajo do të shkarkohet dy herë më shpejtë (30 minuta). Një vlerë shkarkuese prej 1C në një bateri prej 1.6 Ah nënkupton një rrymë shkarkuese prej 1.5 A. Një vlerës 2C do të nënkuptonte një rrymë shkarkuese prej 3.2 A. Standardet për një bateri të ringarkueshme në përgjithësi vlerëson kapacitetin në 4 orë, 8 orë ose distancë më të madhe shkarkuese. Për shkak të humbjes në rezistencë të brendshme dhe proceseve kimike brenda qelizave, një bateri rrallë mund të dorëzojë kapacitetin e vlerësuar në vetëm një orë. Llojet e menduara për qëllime speciale, si në një kompjuter ku nuk ndërprehet furnizimi me energji elektrike, mund të vlerësohet nga prodhuesit për periudha shkarkuese më shumë se vetëm një orë.
Ngarkimi i shpejtë, bateritë e mëdha dhe të ndritshme
[Redakto | Redakto nëpërmjet kodit]Në vitin 2012 bateria teknologjike Litium hekur fosfat (LiFePO4) ishte më e shpejta në ngarkim/shkarkim, duke u shkarkuar plotësisht në 10-20 sekonda. [25]
Në vitin 2013, bateria më e madhe në botë ishte në Provincën Hebei, Kinë.[26] Ajo ruante 36 megavat-orë të elektriciteti në vlerë prej $500 milionë. Një tjetër bateri e madhe, e përbërë nga qelizat Ni-Cd, ishte në Fairbanks, Alaskë. Ajo mbulonte 2,000 metra katrorë – më e madhe se një fushë futbolli – dhe me peshë prej 1,300 tonë. Ajo u prodhua në ABB për të siguruar fuqinë rezervë në ngjarjen e errësimit të plotë. Bateria mund të sigurojë 40 megavat për fuqi deri në 7 minuta.[27] Bateritë sodium-sulfur u përdorën për të ruajtur fuqinë e erës.[28] Një bateri e sistemit 4.4 megavat-orë mund të dorëzojë 11 megavat për 25 minuta duke stabilizuar hyrjen në fermën e erës Auëahi në Hawaii.[29] Bateritë litium-sulfur u përdorën në fluturimin më të gjatë dhe më të lartë të fuqisë solare.[30] Shpejtësia ringarkuese e baterive të jon-litiumit mund të rritet duke ndërruar prodhuesit.[31]
Jetëgjatësia e baterisë
[Redakto | Redakto nëpërmjet kodit]Kapaciteti i disponueshëm i të gjitha baterive bjen me rënien e temperaturës. [32] Ndryshe nga bateritë e sotme, pila Zamboni, e zbuluar në vitin 1812, ofron një shërbim të gjatë pa pasur nevojë për renovim ose ringarkim, megjithëse ajo furnizon rrymën vetëm në shkallë prej nanoamperash. Zilja Elektrike e Oksfordit ka rënë pothuajse njëtrajtësisht që nga viti 1840 në baterinë e saj origjinale, mendohet të jetë pilë Zamboni.
Vetë-shkarkimi
[Redakto | Redakto nëpërmjet kodit]Bateritë e disponueshme tipikisht humbin 8 deri në 20 përqind të ngarkesës së tyre origjinale për vit kur ruhen në temperaturë të dhomës (20°–30 °C). Kjo njihet si shkallë “vetë-shkarkuese”, dhe është për shkak të mos prodhimit të rrymës të reaksioneve kimike “anësore” që ndodh brenda në qelizë edhe kur nuk ka ngarkesa. Vlerësimi i reaksioneve anësore është reduktuar për bateritë e ruajtura në temperaturat e ulëta, megjithëse disa mund të shkatërrohen nga ngrirja.
Bateritë e vjetra të ringarkueshme vetë-shkarkohen më shpejt sesa bateritë e disponueshme alkaline, veçanërisht bateritë nikel-bazike; bateria e freskët nikel kadmium (NiCd) humb 10% të ngarkesës së tij në 24 orët e para, dhe pasja shkarkohet në shkallë për rreth 10% në muaj. Megjithatë, bateritë e reja vetë-shkarkuese të ulëta nikel metal hidride (NiMH) dhe dizajnet moderne të litiumit paraqitet në një shkallë më të ulët të vetë-shkarkuese (por akoma më të lartë sesa bateritë primare).
Korrezioni
[Redakto | Redakto nëpërmjet kodit]Pjesët e brendshme mund të korrodohen dhe të bien, ose materialet aktive mund të konvertohen ngadalë në forma inaktive.
Ndryshimet në përbërësit fizikë
[Redakto | Redakto nëpërmjet kodit]
Materiali aktiv në pllaka të baterisë ndryshon kompozicionin kimik në secilin qark ngarkues dhe shkarkuese, materialet aktive mund të humben për shkak të ndryshimeve fizike të vëllimit; më pas duke kufizuar numrin e herëve që bateria mund të ringarkohet.
Shumica e baterive nikel-bazike janë pjesërisht shkarkohen kur blihen, dhe duhet të ngarkohet para përdorimit të parë.[33] Bateritë e reja NiMH janë të gatshme për përdorim kur blihen, dhe kanë vetëm 15% shkarkim në vit.[34]
Disa dëmtime ndodhin në secilin qark ngarkuese-shkarkues. Degradimi zakonisht ndodh sepse elektrolita migron nga elektroda ose sepse materiali aktiv shkëputet nga elektrodat.
Bateritë NiMH kapacitet-ulët (1700 – 2000 mA h) mund të ngarkohet deri në 1,000 herë, kurse bateritë NiMH kapacitet-lartë (mbi 2500 mA h) zgjat deri në 500 qarqe.[35] Bateritë NiCd tentojnë të vlerësohen për 1,000 qarqe para se rezistenca e tyre e brendshme rritet pas vlerave të dobishme.
===Shpejtësia ngarkim/shkarkim=== Ngarkimi i shpejtë rrit ndryshimin e komponentëve, duke shkurtuar jetëgjatësinë e baterisë. === Shpejtësia ngarkim / shkarkim === Ngarkimi i shpejtë rrit ndryshimin e komponentëve, duke shkurtuar jetëgjatësinë e baterisë. [35] [35]
Mbingarkimi
[Redakto | Redakto nëpërmjet kodit]Nëse ngarkuesi nuk mund ta detektojë kur bateria është e mbushur atëherë mbingarkimi e dëmton atë. [36]
Efekti i memories
[Redakto | Redakto nëpërmjet kodit]Qelizat NiCd, nëse përdoret në një mënyrë të veçantë përsëritëse, mund të shfaq një rënien në kapacitet që quhet “efekti i memories”. [37] Efekti mund të shmanget me praktikë të thjeshtë. Qelizat NiMH, megjithëse të ngjashme në kimi, vuajnë më shumë nga efekti i memories. [38]

Kushtet mjedisore
[Redakto | Redakto nëpërmjet kodit]Bateritë e ringarkueshme vetëlëvizës plumb-acidike e durojnë stresin për shkak të vibrimit, shokut, dhe shkallës së temperaturës. Për shkak të këtyre streseve dhe fulfacionit në pllakat e ngarkuara, disa bateri vetëlëvizëse qëndrojnë pas gjashtë viteve të përdorimit të rregullt. [39] Bateritë vetëlëvizëse startuese kanë disa pllaka të holla për të maksimizuar rrymën. Në përgjithësi, sa më të holla pllakat aq më e gjatë jeta e saj. Ato janë tipikisht të shkarkuara vetëm pak para ringarkimit.
Bateritë plumb-acidike “qark-thella” si ato të përdorura në kartat e golfit elektrik kanë pllaka më të holla për të zgjatur jetëgjatësinë. [40] Përfitimi kryesor i baterive plumb-acidike është taksa e ulët e tyre; e meta më e madhe e tyre është madhësia e madhe dhe pesha për kapacitet dhe tension të dhënë.
Bateritë plumb-acidike nuk mund të shkarkohen më shumë se 20% të kapacitet të tyre, [41] sepse rezistenca e tyre e brendshme do të shkaktojë nxehtësi dhe dëme kur atë ringarkohen. Sistemet plumb-acidike qark-thella shpesh përdorin një dritë paralajmëruese ngarkesë-ulët ose ndërprerës të fuqisë së ngarkesës-ulët për të paralanduar llojin e dëmit që do ta shkurtonte jetën e baterisë. [42]
Ruajtja
[Redakto | Redakto nëpërmjet kodit]Jeta e baterisë mund të zgjatet nëse bateria ruhet në temperaturë të ulët, si në frigorifer ose në friz, e cila ngadalëson reaksionet anësore. Ruajtja e tillë mund të rritë jetën e baterive alkaline deri në 5%; bateritë e ringarkueshme mund ta mbajnë ngarkesën më gjatë, varësisht nga lloji. [43] Për të arritur tensionin maksimal, bateritë mund të rikthehen në temperaturë të dhomës; shkarkimi në bateri alkaline në 250 mA në 0 °C është vetëm gjysma e efikasitetit të 20 °C. [20] Për bateritë alkaline nuk rekomandohet ngrirja. [19]
Qelizat e bëra në shtëpi
[Redakto | Redakto nëpërmjet kodit]Pothuajse lëng ose objekt i lagësht që ka jone të mjaftueshme për të qenë elektrikisht përçues mund të shërbejë si elektrolit për një qelizë. Si risi ose si demonstrim shkencor, është e mundshme të futen dy elektroda të përbëra nga metale të ndryshme brenda një limoni, [44] patateje, [45] etj. dhe gjenerohet një sasi e vogël e elektricitetit. “Orët dy-patateshe” janë po ashtu gjerësisht të disponueshme në dyqane lojërash; ato përbëhen nga një çift qelizash, secila e përbërë nga një patate (limon, etj) me dy elektroda të futura në të, të telëzuara në seri për të krijuar një bateri me tension të mjaftueshëm për të fuqizuar një orë digjitale. [46] Qelizat e bëra në shtëpi të këtij lloje nuk janë praktike.
Pila voltaike e bërë nga dy mondesha (si një nikel dhe një peni) dhe një copë e facoletës e zhytur në ujë të kripur. Një pilë e tillë gjeneron një tension shumë të ulët, por shumë janë të vendosura në seri, mund t’i zëvendësojnë bateritë normale për një kohë të shkurtër. [47]
Sony ka zbuluar një bateri biologjike që gjeneron elektricitet nga sheqeri në të njëjtën mënyrë si procesi i vëzhgimit të organizmave duke jetuar. Bateri gjeneron elektricitetit përmes përdorimit të enzimeve që thyejnë karbohidratet. [48]
Qelizat plumb-acidike mund të prodhohen lehtë në shtëpi, por një qark i lodhshëm ngarkim/shkrakim është i nevojshëm për të “formuar” pllakat. Ky është një proces në të filin formohen sulfatet e plumbit në pllaka, dhe gjatë ngarkimit konvertohet në dioksid plumbi (pllaka pozitive) dhe plumb i pastër (pllaka negative). Duke e përsëritur këtë proces rezultojmë në një sipërfaqe të përafërt mikroskopisht, duke e rritur sipërfaqen. Kjo e rrit rrymën që qeliza mund të dorëzojë. [49]
Qelizat Daniell janë po ashtu të lehta për tu bërë në shtëpi. Bateritë alumin-ajër mund të prodhohen me alumin të pastër. Bateritë alumin karburante do të prodhojnë elektricitet, por nuk janë efikase, për shkak të sasisë së gazit hidrogjenor që prodhohet.
Legjislacioni dhe rregullimi
[Redakto | Redakto nëpërmjet kodit]Legjislacioni rreth baterive elektrike përfshin tema të tilla si asgjësimi i sigurt dhe riciklimi.
Në Shtetet e Bashkuara, Akti i Menaxhimit të Baterive Mërkur Përmbajtëse dhe të Rikarikueshme i vitit 1996 ndaloi shitjen e baterive që përmbajnë mërkur, miratoi kërkesa uniforme të etiketimit për bateritë e ringarkueshme dhe kërkoi që bateritë e ringarkueshme të jenë lehtësisht të heqhme. [50] Kalifornia dhe Nju Jork Siti ndalojnë asgjësimin e baterive të rikarikueshme në mbetjet e ngurta. [51][52] Industria e baterive të rikarikueshme operon programe riciklimi mbarëkombëtar në Shtetet e Bashkuara dhe Kanada, me pika të shkarkimit në shitësit lokalë. [53]
Direktiva e Baterive e Bashkimit Europian ka kërkesa të ngjashme, me shtesë që kërkon riciklimin e shtuar të baterive dhe promovimin e studimit mbi metodat e përmirësuara të riciklimit të baterive. [54] Në përputhje me këtë direktivë, të gjitha bateritë që do të shiten brenda BE-së duhet të shënohen me "simbolin e grumbullimit" (një kosh me rrota të kryqëzuar). Kjo duhet të mbulojë të paktën 3% të sipërfaqes së baterive prizmatike dhe 1.5% të sipërfaqes së baterive cilindrike. Të gjitha paketimet duhet të jenë të shënuara po ashtu. [55]
Në përgjigje të aksidenteve dhe dështimeve të raportuara, herë pas here ndezje apo shpërthim, tërheqjet e pajisjeve që përdorin bateri litium-jon janë bërë më të zakonshme vitet e fundit. [56][57]
Më 09-12-2022, Kuvendi i BE-së arriti një marrëveshje për të detyruar, nga viti 2026, prodhuesit të dizajnojnë të gjitha pajisjet elektrike të shitura në BE (dhe jo të përdorura kryesisht në kushte të lagështa) në mënyrë që konsumatorët të mund t'i heqin dhe zëvendësojnë me lehtësi bateritë vetë. [58][59]
Referime
[Redakto | Redakto nëpërmjet kodit]- ^ Alarco, Jose; Talbot, Peter (30 Prill 2015). "The history and development of batteries". phys.org (në anglisht).
{{cite web}}: Shiko vlerat e datave në:|date=(Ndihmë!) - ^ ""Electrical battery" of Leyden jars, 1760-1769". http://www.benfranklin300.org (në anglisht).
{{cite web}}: Lidhje e jashtme në|website= - ^ Bellis, Mary. "Biography of Alessandro Volta, Inventor of the Battery". About.com (në anglisht). Marrë më 7 Gusht 2008.
{{cite web}}: Shiko vlerat e datave në:|access-date=(Ndihmë!) - ^ Stinner, Arthur (20 Nëntor 2006). "Alessandro Volta and Luigi Galvani" (PDF). http://home.cc.umanitoba.ca (në anglisht dhe italisht). Arkivuar nga origjinali (PDF) më 10 Shtator 2008.
{{cite web}}: Lidhje e jashtme në|website=|date=dhe|archive-date=(Ndihmë!) - ^ "Fascinating facts about the invention of the Electric Battery by Alessandro Volta in 1800". The Great Idea Finder (në anglisht). Arkivuar nga origjinali më 22 Shkurt 2019. Marrë më 11 Gusht 2008.
{{cite web}}: Shiko vlerat e datave në:|access-date=dhe|archive-date=(Ndihmë!) - ^ "Battery History, Technology, Applications and Development". The Electropedia (në anglisht). Arkivuar nga origjinali më 2 prill 2019. Marrë më 19 Mars 2007.
{{cite web}}: Shiko vlerat e datave në:|access-date=(Ndihmë!) - ^ Borvon, Gérard (10 Shtator 2012). "History of the electrical units". Association S-EAU-S (në anglisht).
{{cite web}}: Shiko vlerat e datave në:|date=(Ndihmë!) - ^ "Columbia Dry Cell Battery". National Historic Chemical Landmarks (në anglisht). American Chemical Society. 27 Shtator 2005. Arkivuar nga origjinali më 23 Shkurt 2013. Marrë më 25 Mars 2013.
{{cite web}}: Shiko vlerat e datave në:|access-date=,|date=, dhe|archive-date=(Ndihmë!) - ^ Dingrando 665.
- ^ Dingrando 666.
- ^ a b Knight 943.
- ^ Knight 976.
- ^ Terminal Voltage – Tiscali Reference Arkivuar 11 prill 2008 tek Wayback Machine. Originally from Hutchinson Encyclopaedia. Retrieved 7 April 2007.
- ^ Dingrando 674.
- ^ Dingrando 677.
- ^ Dingrando 675.
- ^ Fink, Ch. 11, Sec. "Batteries and Fuel Cells."
- ^ Franklin Leonard Pope, Modern Practice of the Electric Telegraph 15th Edition, D. Van Nostrand Company, New York, 1899, pages 7–11. Available on the Internet Archive
- ^ a b Duracell: Battery Care. Retrieved 10 August 2008.
- ^ a b Alkaline Manganese Dioxide Handbook and Application Manual Arkivuar 16 dhjetor 2010 tek Wayback Machine (PDF). Energizer. Retrieved 25 August 2008.
- ^ "Spotlight on Photovoltaics & Fuel Cells: A Web-based Study & Comparison" (PDF). fq. 1–2. Marrë më 14 mars 2007.
{{cite web}}: Mungon ose është bosh parametri|language=(Ndihmë!) - ^ a b "Battery Knowledge – AA Portable Power Corp. Retrieved 16 April 2007". Arkivuar nga origjinali më 23 maj 2007. Marrë më 14 prill 2015.
{{cite web}}: Mungon ose është bosh parametri|language=(Ndihmë!) - ^ Battery Capacity – Techlib. Retrieved 10 April 2007
- ^ A Guide to Understanding Battery Specifications, MIT Electric Vehicle Team, December 2008
- ^ Stampa:Cite doi 1:00–6:50 (audio) Arkivuar 22 shkurt 2012 tek Wayback Machine
- ^ Dillow, Clay (21 dhjetor 2012). "China Builds the World's Largest Battery, a Building-Sized, 36-Megawatt-Hour Behemoth | Popular Science". Popsci.com. Marrë më 31 korrik 2013.
{{cite web}}: Mungon ose është bosh parametri|language=(Ndihmë!) - ^ Conway, E. (2 September 2008) "World's biggest battery switched on in Alaska" Arkivuar 23 dhjetor 2012 tek Archive.today Telegraph.co.uk
- ^ Biello, D. (22 December 2008) "Storing the Breeze: New Battery Might Make Wind Power More Reliable" Scientific American
- ^ "Auwahi Wind | Energy Solutions | Sempra U.S. Gas & Power, LLC". Semprausgp.com. Arkivuar nga origjinali më 2 maj 2014. Marrë më 31 korrik 2013.
{{cite web}}: Mungon ose është bosh parametri|language=(Ndihmë!) - ^ Amos, J. (24 August 2008) "Solar plane makes record flight" BBC News
- ^ Increasing recharge speed of lithium-ion batteries
- ^ Self discharge of batteries – Corrosion Doctors. Retrieved 9 September 2007.
- ^ Energizer Rechargeable Batteries and Chargers: Frequently Asked Questions Arkivuar 9 shkurt 2009 tek Wayback Machine. Energizer. Retrieved 3 February 2009.
- ^ "Kopje e arkivuar". Arkivuar nga origjinali më 2 shkurt 2010. Marrë më 14 prill 2015.
{{cite web}}: Mungon ose është bosh parametri|language=(Ndihmë!)Mirëmbajtja CS1: Archived copy si titull (lidhja) - ^ a b c Rechargeable battery Tips – NIMH Technology Information. Retrieved 10 August 2007. Arkivuar 8 gusht 2007 tek Wayback Machine
- ^ battery myths vs battery facts – free information to help you learn the difference. Retrieved 10 August 2007.
- ^ Repair FAQ, quoting GE tech note
- ^ RechargheableBatteryInfo.com, red. (28 tetor 2005), What does 'memory effect' mean?, arkivuar nga origjinali më 15 korrik 2007, marrë më 10 gusht 2007
{{citation}}: Mungon ose është bosh parametri|language=(Ndihmë!) - ^ Rich, Vincent (1994). The International Lead Trade. Cambridge: Woodhead. 129.
- ^ Deep Cycle Battery FAQ Arkivuar 22 korrik 2010 tek Wayback Machine. Northern Arizona Wind & Sun. Retrieved 3 February 2009.
- ^ Car and Deep Cycle Battery FAQ Arkivuar 6 nëntor 2020 tek Wayback Machine. Rainbow Power Company. Retrieved 3 February 2009.
- ^ Deep cycle battery guide Arkivuar 17 shkurt 2009 tek Wayback Machine. Energy Matters. Retrieved 3 February 2009.
- ^ Ask Yahoo: Does putting batteries in the freezer make them last longer? Arkivuar 27 prill 2006 tek Wayback Machine. Retrieved 7 March 2007.
- ^ ushistory.org: The Lemon Battery. Accessed 10 April 2007.
- ^ ZOOM activities: phenom Potato Battery. Accessed 10 April 2007.
- ^ Two-Potato Clock – Science Kit and Boreal Laboratories Arkivuar 24 nëntor 2020 tek Wayback Machine. Accessed 10 April 2007.
- ^ Howstuffworks "Battery Experiments: Voltaic Pile". Accessed 10 April 2007.
- ^ Sony Develops A Bio Battery Powered By Sugar Arkivuar 11 tetor 2007 tek Wayback Machine. Accessed 24 August 2007.
- ^ "Home made lead acid batteries". Windpower.org.za. 16 shtator 2007. Arkivuar nga origjinali më 31 korrik 2013. Marrë më 26 korrik 2013.
{{cite web}}: Mungon ose është bosh parametri|language=(Ndihmë!) - ^ "The Mercury-Containing and Rechargeable Battery Management Act" (PDF). EPA (në anglisht). 13 Maj 1996. Marrë më 15 Shkurt 2021.
{{cite web}}: Shiko vlerat e datave në:|access-date=dhe|date=(Ndihmë!) - ^ "Battery Recycling in New York... it's the law!". call2recycle (në anglisht). Marrë më 2 Qershor 2021.
{{cite web}}: Shiko vlerat e datave në:|access-date=(Ndihmë!) - ^ "Bill No. 1125 - Rechargeable Battery Recycling Act of 2006, State of California" (PDF) (në anglisht). Marrë më 2 Qershor 2021.
{{cite web}}: Shiko vlerat e datave në:|access-date=(Ndihmë!) - ^ "FREQUENTLY ASKED QUESTIONS". Rechargeable Battery Recycling Corporation (në anglisht). Arkivuar nga origjinali më 12 Gusht 2008. Marrë më 15 Janar 2022.
{{cite web}}: Shiko vlerat e datave në:|access-date=dhe|archive-date=(Ndihmë!) - ^ "Disposal of spent batteries". EUR-Lex (në anglisht, frëngjisht, gjermanisht, spanjisht, italisht, dhe greqisht). Marrë më 27 Korrik 2009.
{{cite web}}: Shiko vlerat e datave në:|access-date=(Ndihmë!) - ^ "Guidelines on Portable Batteries Marking Requirements in the European Union" (PDF). EPBA-EU (në anglisht). Arkivuar nga origjinali (PDF) më 7 Tetor 2011.
{{cite web}}: Shiko vlerat e datave në:|archive-date=(Ndihmë!) - ^ Schweber, Bill (4 Gusht 2015). "Lithium Batteries: The Pros and Cons". GlobalSpec (në anglisht). Marrë më 15 Mars 2017.
{{cite web}}: Shiko vlerat e datave në:|access-date=dhe|date=(Ndihmë!)Mirëmbajtja CS1: Gjendja e adresës (lidhja) - ^ Fowler, Suzanne (21 shtator 2016). "Samsung's Recall – The Problem with Lithium Ion Batteries". The New York Times (në anglisht). New York City. Marrë më 15 mars 2016.
- ^ "Batteries: deal on new EU rules for design, production and waste treatment". European Parliament (në anglisht). 2022-12-09. Arkivuar nga origjinali më 2022-12-05. Marrë më 2022-12-11.
{{cite web}}: Mospërputhje stampash kohore te|archive-date=/|archive-url=; sugjerohet 2022-12-11 (Ndihmë!) - ^ "Neue EU-Regeln: Jeder soll Handy-Akkus selbst tauschen können". Der Spiegel (në gjermanisht). 2022-12-09.
{{cite news}}:|access-date=ka nevojë për|url=(Ndihmë!);|archive-url=ka nevojë për|url=(Ndihmë!)










